|
Avertissement
|
Si
vous arrivez directement sur cette page, sachez que
ce travail est un rapport d'étudiants et doit être
pris comme tel. Il peut donc comporter des
imperfections ou des imprécisions que le lecteur
doit admettre et donc supporter. Il a été réalisé
pendant la période de formation et constitue
avant-tout un travail de compilation
bibliographique, d'initiation et d'analyse sur des
thématiques associées aux technologies biomédicales.
Nous ne faisons aucun
usage commercial et la duplication est libre. Si
vous avez des raisons de contester ce droit
d'usage, merci de
nous en faire part . L'objectif de
la présentation sur le Web est de permettre l'accès
à l'information et d'augmenter ainsi les échanges
professionnels. En cas d'usage du document,
n'oubliez pas de le citer comme source
bibliographique. Bonne lecture...
|
|
EVALUATION DE LA GESTION DES EQUIPEMENTS DU
LABORATOIRE DU GRAND HÔPITAL DE L’EST FRANCILIEN
(GHEF)
SELON LA NORME NF EN ISO 15189 : 2012
|

UNIVERSITE
DE TECHNOLOGIE DE COMPIÈGNE
|
|

GRAND HÔPITAL DE L'EST FRANCILIEN
|
Référence à
rappeler : Evaluation de la gestion des
équipements du laboratoire du grand hôpital de l’est
francilien (GHEF) selon la norme NF EN ISO 15189 : 2012.
Auteurs: SANOU Bakary Aimé ; Certification
Professionnelle ABIH, UTC, 2017
URL : http://www.utc.fr/abih
; Université
de Technologie de Compiègne
|
|
RESUME
Suite à la loi n°
2013-442, Art 4, Art L6221-1 du 30 mai 2013, qui rend
obligatoire l’accréditation des laboratoires de
biologies médicales, le laboratoire du Grand Hôpital de
l’Est Francilien (GHEF) est rentré dans l’accréditation
ISO 15189 / 2007 depuis juin 2014.Avec l’évolution de la
norme, la version 15189 / 2012 est rentré en vigueur en
novembre 2016. Cette dernière met l'accent sur deux
principes : l'approche processus, qui permet d’améliorer
en continue le fonctionnement du laboratoire de biologie
médicale, et la gestion des risques, afin d’anticiper
tout incident et d’y répondre de manière adaptée en cas
de survenance. Face à cette situation le service
biomédical du GHEF nous à confier la mission d’évaluer
la gestion des équipements du laboratoire selon cette
nouvelle version de la norme, afin d’anticiper les
écarts avant la visite du Comité français
d'accréditation (COFRAC) prévu en juillet 2017.
Pour répondre à ce
besoin, nous avons eu une expérience incluant la
création d’un outil d’évaluation basé sur la norme ISO
15189 / 2012 et la distribution d’un questionnaire sur
la gestion des équipements du laboratoire. Les
participants ont permis l’obtention des données qui ont
servis à l’évaluation. Le résultat obtenu montre une
bonne gestion du parc équipements du laboratoire. Ces
résultats nous ont permis également de faire des
recommandations qui permettrons de répondre plus
efficacement aux attentes de la norme en vigueur.
A partir de ces
conclusions, nous sommes satisfaits d’avoir contribuer à
l’atteinte des objectifs du laboratoire dans sa lancé
dans la démarche d’accréditation, et nous souhaitons que
cet outil que nous avons mis en place puisse servir aux
responsables de la gestion des équipements du
laboratoire notamment les services biomédicaux.
Mots clés : Laboratoire de biologie médicale;
Norme ISO 15189 ; Evaluation de laboratoire; Service
biomédicale; Certification ; accréditation.
|
|
ABSTRACT
In accordance with the law
n ° 2013-442, Art 4, Art L6221-1 of 30 May 2013, which
makes accreditation of laboratories of medical biology
compulsory, the laboratory of the Grand Hospital of East
Francilien (GHEF) Accreditation ISO 15189/2007 since
June 2014. With the evolution of the standard, version
15189/2012 came into force in November 2016. The latter
emphasizes two principles: the process approach, which
allows Continuously improve the functioning of the
medical biology laboratory and risk management in order
to anticipate any incident and to respond appropriately
in the event of an accident. In view of this situation,
the GHEF biomedical department entrusted us with the
task of evaluating the management of laboratory
equipment according to this new version of the standard
in order to anticipate the discrepancies before the
visit of the French Accreditation Committee (COFRAC) In
July 2017.
To meet this need, we had experience including the
creation of an evaluation tool based on the ISO
15189/2012 standard and the distribution of a
questionnaire on the management of laboratory equipment.
The participants were able to obtain the data that were
used for the evaluation. The result obtained shows good
management of the equipment of the laboratory. These
results have also enabled us to make recommendations
that will enable us to respond more effectively to the
expectations of the current standard.
Based on these conclusions, we are pleased to have
contributed to the achievement of the objectives of the
laboratory in its approach to accreditation, and we hope
that this tool that we have put in place can be used by
those responsible for management Laboratory equipment
including biomedical services.
Key words : Laboratory of
Medical Biology; ISO standard 15189;
Laboratory evaluation; Biomedical
services; Certification; accreditation.
|
Télécharger:
Le
rapport de stage  L'outil
d'évaluation
L'outil
d'évaluation  Le poster
Le poster 
|

|
Remerciements
La réalisation de ce stage a été possible grâce au concours de
plusieurs personnes à qui je voudrais témoigner toute ma
reconnaissance.
Qu’il me soit permis de les remercier singulièrement :
- M. Hervé MIGNARDOT, Adjoint au directeur technique pour ses
encadrements multiforme et pour la confiance qu’il m’a accordé
pour le choix de ce thème.
- M. Benoit HERNADEZ, Ingénieur des trois sites du GHEF, pour
ses explications éclairées du fonctionnement du service
biomédical.
- M. David DA COSTA Responsable du service biomédical du site
marne-la-vallée, pour son accueil, sa confiance, le temps qu’il
m’a consacré tout au long du stage.
- M. Patrick BURAT Expert technique en biomédical pour les
réponses à mes questions et ses diverses interventions qui m’ont
aidé.
- Mme Djamila DESFORGES assistante du service biomédical pour sa
sympathie.
- Les techniciens biomédicaux :
- M. Saul FERNADES
- M. Julien MENDEZ
- M. Cyprien DUPRIEZ
Pour m’avoir permis de m’intégrer rapidement à travers leur
sympathie, leur disponibilité et pour les savoirs qu’ils m’ont
transmis durant ce stage :
- Les responsables du laboratoire pour leurs collaborations :
- Dr Mourad BENDAOUD Chef du pôle biopathologie du territoire
et Responsable Assurance Qualité du laboratoire multisite
- Mme. Laurence PAINT Cadre du laboratoire site
marne-la-vallée.
- M. Stéphane DEVILLERS Responsable métrologie du laboratoire,
pour sa disponibilité, ses explications et les documents qu’il
m’a gracieusement fournis.
- A mes encadreurs de l’Université de Technologie de Compiègne
(UTC) :
- M. Gilbert Farges Docteur-Ingénieur- Chercheur à l’UTC,
- M. Pol-manoël Felan Responsable pédagogique de la formation
- Mme Nathalie Moutonnet assistante ABIH pour sa sympathie, sa
bonne humeur et ses soutiens divers.
- Mes camarades de classe.
Je n’oublie pas évidemment mes
camarades de stage et les remercie chaleureusement pour tous ces
agréables moments passés ensemble.
Je tiens enfin à remercier tout
particulièrement ma famille qui m’a accordé la liberté d’action et
la patience nécessaires pour réaliser ce travail ainsi que toutes
les personnes qui m’ont soutenue.
Sommaire
INTRODUCTION
- CONTEXTE REGLEMENTAIRE ET
NORMATIF
- Bonne exécution des analyses de
biologie médicale (GBEA)
- Norme NF
EN ISO 15189
- 1. Les normes fondatrices de
NF EN 15189
- CONTEXTE PARTICULIER
DU GRAND HÔPITAL DE L’EST FRANCILIEN
- Présentation du Grand
Hôpital de l’Est Francilien (GHEF)
- 1. Les services du Grand
hôpital de l’Est Francilien
- 2. Le service biomédical
- 2.1. Rôle du
personnel biomédical
- 2.2. L’atelier
du service biomédical
- 3. Le Laboratoire
multisite de Biologie Médicale
- 3.1. Structure juridique du
laboratoire
- 3.2. Présentation du
laboratoire
- 3.3. Les activités
d’analyse du laboratoire
- 3.4. Gestion des
équipements du laboratoire
- 3.5. Les accréditations du
laboratoire
- 3.6. Impacts du
regroupement des trois sites sur le laboratoire
- Contexte et attendus de
l’étude
- EVALUATION DU
LABORATOIRE DU GHEF
- L’outil d’évaluation
- Déroulement de
l’étude, entretiens préalables et recueille des
données
- Bilan de l’évaluation
- RECOMMANDATIONS EVOLUTIVES
VALIDEES
- Recommandation
sur les activités non conformes
- Mise
en place d’un système stratégique d’amélioration continue
- ACTIVITES CONNEXES
- Gestion de la
Maintenance Assistée par Ordinateur (GMAO)
- La maintenance
des équipements biomédicaux
- CONCLUSION GENERALE
- BIBLIOGRAPHIE
- ANNEXES
Table des illustrations
FIGURE 1 ORGANIGRAMME
DU GHEF
FIGURE 2 ORGANIGRAMME
DU SERVICE BIOMEDICAL
FIGURE 3 ZONE
D'ATTENTE DE REPARATION
FIGURE 4 ZONE
DE REPARATION
FIGURE 5 ZONE
D'ATTENTE DE PIECE DE RECHANGE
FIGURE 6 ZONE DE TEST
FIGURE 7 ZONE DE RETOUR SERVICES
FIGURE 8 RECENSEMENT
METROLOGIQUE DES EQUIPEMENTS
FIGURE 9 LOGIGRAMME
DE GESTION DES EQUIPEMENTS
FIGURE 10 FORMULATION
DE LA PROBLEMATIQUE
FIGURE 11 PRESENTATION
DE L'OUTILS D'EVALUATION
FIGURE 12 ONGLET
D'INSERTION DES DONNEES
FIGURE 13 ONGLET DES RESULTATS SOUS FORME DE
LOGIGRAMME
FIGURE 14 ONGLET DE DECLARATION DE CONFORMITE
FIGURE 15 DECLARATION
DE LA CONFORMITE DE L'EVALUATION
FIGURE 16 LE
GRAPHIQUE DE L'EVALUATION PAR ARTICLE
FIGURE 17 LE
GRAPHIQUE DE L'EVALUATION PAR SOUS ARTICLE
FIGURE 18 SYNTHESE
DE L'EVALUATION
FIGURE 19 CYCLE
D'AMELIORATION CONTINUE
FIGURE 20 SCHEMA
DE MAINTENANCE PREVENTIVE
Glossaire des sigles et
abréviations
retour sommaire
B
B.T
.............................................................................................................................Bon
de travail
CH...............................................................................................................................Centre
hospitalier
CHU............................................................................................................................Centre
Hospitalier Universitaire
COFRAC...............................................................................................................
.......Comité français d’accréditation
D.I
.............................................................................................................................demandes
d’intervention
DU...............................................................................................................................Diplôme
Universitaire
F.M.P............................................................................................................................fiches
de maintenance préventive
GBEA
...........................................................................................................................Bonne
exécution des analyses de biologie médicale
GHEF
...........................................................................................................................Grand
Hôpital de l’Est Francilien
GMAO
..........................................................................................................................Gestion
de Maintenance Assistée par Ordinateur
HAS
.............................................................................................................................Haute
Autorité de Santé
ISO..............................................................................................................................Organisation
internationale de normalisation
LBM
.............................................................................................................................laboratoires
de biologie médicale
MCO
............................................................................................................................médecine,
chirurgie, obstétrique
QQOQCP......................................................................................................................Qui,
Quoi, Où, Quand, Comment, Pourquoi
R.I
.............................................................................................................................Rapports
d’interventions
RAQ............................................................................................................................responsable
assurance qualité
RSQM..........................................................................................................................Registre
Sécurité, Qualité et Maintenance
UTC
...........................................................................................................................Université
de Technologie de Compiègne
Introduction
L’accréditation de tous les laboratoires de
biologie médicale (LBM) doit intervenir au plus tard le 1er
novembre 2020.A cette date, l’accréditation devra porter sur 100 %
des examens réalisés ; elle devra porter sur 70 % des examens au
1er novembre 2018 et 50 % des examens au 1er novembre 2016, un
grand objectif annoncé dans l’article 69 de la loi
HPST (Hôpital , Patient, Santé et Territoire) a été rendue
obligatoire par l’ordonnance n° 2010-49 du 13 janvier 2010,
ratifiée par la loi n° 2013-442 du 30 mai 2013 portant réforme de
la biologie médicale et qui en dit long sur les changements futurs
dans le domaine du laboratoire
[1].
Dans le cadre de ma formation d’Assistant Biomédical en Ingénierie
Hospitalière (ABIH) à l'Université de Technologie de Compiègne
(UTC), j'ai souhaité réaliser mon stage dans le Grand Hôpital de
l’Est Francilien (GHEF) répondant à ces enjeux du futur en matière
d’examen dans les laboratoires de biologie médicale tout en me
formant aux métiers du biomédical que j'ai découvert et que ma
formation propose comme débouché.
Le Grand Hôpital de l’Est Francilien (GHEF) est entré dans la
démarche d’accréditation depuis juin 2014, j'ai intégré cette
équipe pour pouvoir découvrir ses méthodes et principes de gestion
des équipements du laboratoire. Nous verrons ainsi au travers de
ce rapport la problématique ou le besoin actuel du secteur du
laboratoire : quels sont les manques à combler ?
Dans un premier temps nous décrirons l’hôpital, son secteur
biomédical, et le laboratoire en insistant sur leurs
fonctionnements notamment dans la gestion des équipements. Puis
nous étudierons mes missions, lors de ce stage avant de dresser un
bilan sur la gestion des équipements du laboratoire.
-
CONTEXTE
REGLEMENTAIRE ET NORMATIF
L’accréditation des laboratoires de biologie médicale (LBM) prévue
par l’article 69 de la loi HPST a été rendue obligatoire par
l’ordonnance n° 2010-49 du 13 janvier 2010, ratifiée par la loi n°
2013-442 du 30 mai 2013 portant réforme de la biologie médicale.
L’article L. 6221-1 du code de la santé publique rend ainsi
l’accréditation obligatoire pour les LBM sur l’ensemble de
l’activité qu’ils réalisent [2].Cette
démarche menée par le Comité français d’accréditation (COFRAC)
repose sur la réglementation existante et sur des normes européennes
harmonisées : pour les LBM, la norme NF EN ISO 15189
[3]; pour les examens de biologie médicale
dont la phase analytique est réalisée hors des LBM (biologie
médicale dite délocalisée), norme NF EN ISO 22870 en complément [4].
L’accréditation de tout LBM doit intervenir au plus tard le 1er
novembre 2020. À cette date, l’accréditation devra porter sur 100 %
des examens réalisés ; elle devra porter sur 70 % des examens au 1er
novembre 2018 et 50 % des examens au 1er novembre 2016. Depuis le
1er novembre 2014, tout LBM doit avoir fait la preuve de son entrée
effective dans la démarche d’accréditation. L’information sur les
décisions d’accréditation, de suspension ou de retrait
d’accréditation des LBM est transmise par le COFRAC à la HAS
(article L. 6221-6. Du CSP) [5] et est présente dans la fiche interface
HAS/ARS. La liste des LBM accrédités est par ailleurs consultable
par les experts-visiteurs de la HAS sur le site du COFRAC
(www.cofrac.fr).
De même, les informations sur la certification des établissements de
santé sont accessibles sur le site de la HAS (www.has-sante.fr).
A terme, les informations sur l’état d’avancement de la démarche
d’accréditation des LBM et sur la certification des établissements
devraient être consultables directement par la HAS et le COFRAC sur
la base Biomédical.
-
Bonne
exécution des analyses de biologie médicale (GBEA)
Le GBEA impose au chapitre II.1.1 l’obligation de s’assurer que «
les installations, l’équipement et l’instrumentation du laboratoire
soient fonctionnels ».
Au chapitre II.3 – entièrement consacré à l’instrumentation, il
précise que l’ensemble des opérations de nettoyage, d’entretien, de
vérification, de réparation et de maintenance effectuées sur les
appareils doit être « consigné par écrit dans un registre de
maintenance affecté à chaque instrument ». Egalement, que le
responsable du laboratoire « doit s’assurer de la mise en œuvre des
moyens métrologiques nécessaires à leur vérification usuelle » et
que « le fonctionnement des appareils doit être vérifié selon la
fréquence préconisée par le fabricant » [6].
La documentation qualité relative aux appareils est également citée
au chapitre II.3 qui indique que « les notices d’utilisation et de
maintenance des appareils doivent être mises en permanence à la
disposition du personnel et respectées ». Plus loin, chapitre
III.1.2, relativement aux procédures et modes opératoires, le GBEA
précise que ces documents concernent notamment « …l’appareillage
(utilisation, entretien, étalonnage, vérification) … » [6].
-
Norme NF EN ISO
15189
Dans le domaine du laboratoire, les exigences de qualité et de
compétence spécifiées dans la norme ISO 15189 renforcent et
explicitent sous différents aspects les exigences du GBEA.
La gestion des équipements s’inscrit d’emblée dans le chapitre 5.3.1
ainsi il est dit que : « Le laboratoire doit disposer d’une
procédure documentée pour la sélection, l’achat et la gestion du
matériel ». Il doit également mettre en place un programme documenté
et enregistré de maintenance préventive et d’étalonnage qui doit au
minimum respecter les recommandations du fabricant ». [3]
Les exigences spécifiées portent successivement sur :
-
1 Les
normes fondatrices de NF EN 15189
La Norme française homologuée par décision du Directeur Général
d'AFNOR le 14 novembre 2012 pour prendre effet le 14 décembre 2012,
remplace la norme homologuée NF EN ISO 15189, d'août 2007 qui est
restée en vigueur jusqu’en novembre 2015.
La Norme européenne EN ISO 15189 :2012 a le statut d’une norme
française et reproduit intégralement la norme internationale ISO
15189 :2012 (version corrigée de 2014) [3].
Elle est fondée sur les normes suivantes :
- ISO 17025 : 2005 (Exigences générales concernant la
compétence des laboratoires d'étalonnages et d'essais)
- ISO 9001 : 2008 (Systèmes de management de la qualité —
Exigences).
La présente norme spécifie les exigences de qualité et de compétence
applicables aux laboratoires de biologie médicale.
Elle s'adresse aux laboratoires de biologie médicale qui élaborent
leurs systèmes de management de la qualité et évaluent leur propre
compétence.
Les clients des laboratoires, les autorités règlementaires ainsi que
les organismes d'accréditation engagés dans des activités de
confirmation ou de reconnaissance de la compétence des laboratoires
de biologie médicale peuvent également s'y référer.
-
CONTEXTE
PARTICULIER DU GRAND HÔPITAL DE L’EST FRANCILIEN
-
Présentation
du Grand Hôpital de l’Est Francilien (GHEF)
Le Grand Hôpital de l’Est Francilien (GHEF) est un nouvel
établissement né le 1er janvier 2017, de l’union de 3 établissements
de médecine, chirurgie, obstétrique (MCO) et Psychiatrie du Nord
Seine-et-Marne : les centres hospitaliers de Coulommiers, de Meaux,
et de Marne-la-Vallée afin de garantir une offre de soins élargie,
efficace et de proximité.
Cette fusion repose sur une ossature médicale : les pôles de
territoire et les fédérations interpolaires. Ces 15 pôles et
fédérations de territoire constituent un établissement fusionné de
premier plan, le plus grand hôpital français hors CHU, avec un
budget annuel d’un demi-milliard d’euros.
Le Grand Hôpital de l’Est Francilien regroupe aujourd’hui 5
structures (hors sites extra-hospitaliers) sur les communes de
Coulommiers (Sites Abel Leblanc et René Arbeltier), de Jossigny
(site de Marne-la-Vallée) et de Meaux (sites Orgemont et
Saint-Faron). Il est composé de 2 000 lits et places, répartis sur
130 services de soins et unités médicales dans lesquels exercent 850
médecins et 5 200 autres professionnels de santé.
Les pôles, fédérations et services de soins du GHEF, sont multisites
et donc tous au service des patients et de la population de
Coulommiers, Marne-la-Vallée et Meaux et de tout le Nord de la
Seine-et-Marne. Ils permettent, par des organisations coordonnées
sur tout le territoire, de renforcer encore les filières de prise en
charge médicale [7].
-
1.Les
services du Grand hôpital de l’Est Francilien
-
Pôle
médecines
- Pôle psychiatrie adultes
- Pôle chirurgies
- Pôle biologie médicale multisite
- Pôle femme/mère/enfant
- Pôle médico-technique (imagerie, urgences, etc.)
- Etc.
-
2. Le service biomédical
Sous la responsabilité hiérarchique de la Direction Générale du
Centre Hospitalier, le
- De maintenir la performance des équipements biomédicaux et
électriques dans le temps, d'adapter leur environnement pour
répondre aux besoins exprimés ou implicites des utilisateurs.
- D'assurer la mise en conformité des équipements pour répondre
aux textes de loi et réglementation en vigueur, dans le respect
de l'environnement,
- D'assurer la sécurité des équipements, la sécurité du site et
les contrôles obligatoires,
- De répondre aux questions concernant la gestion de la
fonction maintenance,en termes de coût, de disponibilité et de
temps,
- De participer au projet Qualité du Centre Hôpital en
proposant un appui technique au sein du groupe de travail,
- De participer à l'investissement et à l'achat des équipements
biomédicaux.
Le service biomédical est l’interface entre le secteur
administratif, le secteur soignant et le secteur médicotechnique.
L’intérêt du service biomédical est de fournir d’une manière
indirecte des prestations de sécurité et de fiabilité pour le
patient.
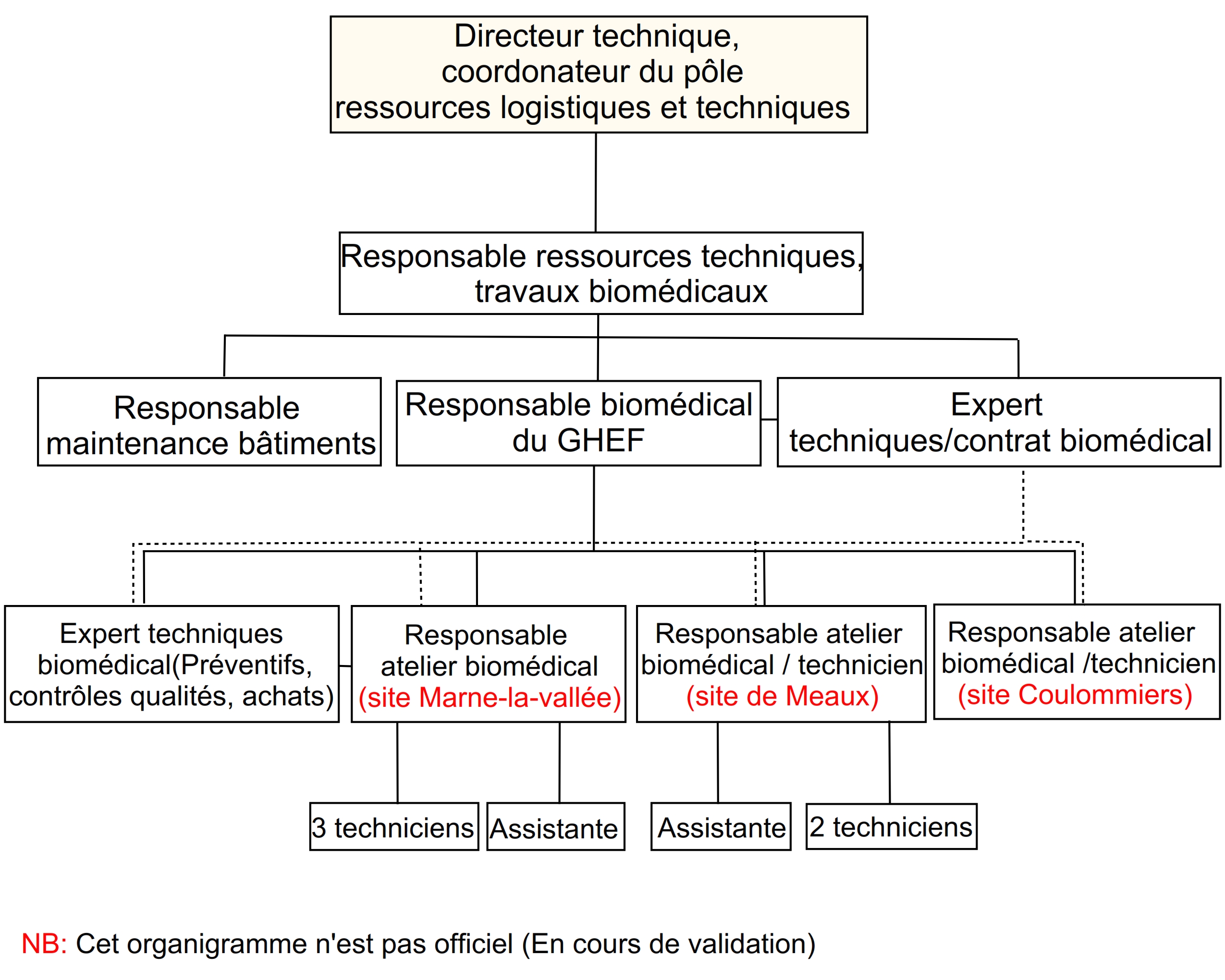
Organigramme du service biomédical
-
2.1. Rôle du
personnel biomédical
L’ingénieurs, et l’expert technique ont pour mission de [8] :
- Préparer des plans d'investissement des dispositifs médicaux
en relation avec les services économiques et les médecins,
- Planifier des achats de dispositifs médicaux,
- Rédiger des cahiers des charges pour les appels d'offre,
- Donner des conseils techniques à l'achat d'équipements
biomédicaux auprès de
- la Direction Générale et du corps médical,
- Mettre en place la démarche qualité au sein du service
biomédical,
- Suivre la réglementation et être en conformité avec les
normes,
- Veille technologique, matériovigilance
- Suivre et gérer les contrats de maintenance,
- Etc.
Le responsable biomédical :
- Suivi des prestataires extérieurs,
- Manager le personnel de l’atelier biomédical et gérer la
maintenance biomédicale,
- Mettre en service et réformer (avec l’avis de ses supérieurs)
les dispositifs médicaux,
- Tracer les interventions dans la GMAO (Gestion de Maintenance
Assistée par Ordinateur).
- Gestion des bons de commande et de réceptions relatifs à la
maintenance,
L’assistante :
- Archivage des bons de commandes et des bons d’intervention,
-
Les techniciens ont pour rôle d’exécuter les interventions suivantes
:
- La maintenance curative de l'ensemble des équipements
- La maintenance préventive et le contrôle qualité de certains
dispositifs médicaux (les défibrillateurs, les matériels de
perfusion etc.)
- Gestion du magasin biomédical,
- Réception du matériel neuf.
- Le stockage et la gestion des pièces détachées.
-
2.2. L’atelier du
service biomédical
Dans le but d’être efficace dans l’exécution de ses missions, le
service biomédical a mis en place dans son atelier, une organisation
selon chaque étape de leur procédure de maintenance. Ainsi l’atelier
est divisé en 5 zones qui sont les suivantes :
- Zone des équipements en attente de réparation.
Le technicien récupère les appareils en panne et les ranges en 1er
lieu dans cette zone.
L’appareil est ensuite diagnostiqué et réparé dans cette zone
- Zone des équipements en attente de pièce de rechange.
Si la pièce de rechange n’est pas disponible l’appareil est placé
dans cette zone.
- Zone de test (contrôle qualité)
L’appareil réparé est ensuite testé et
étalonné dans cette zone
- Zone des équipements prêts pour retourner en service
L’appareil remis en marche, testé et contrôlé est rangé dans cette
zone pour être remis au service
-
3. Le Laboratoire
multisite de Biologie Médicale
-
3.1. Structure juridique du
laboratoire
Nom : Laboratoire de Biologie Médicale multisite du Grand Hôpital de
l’Est Francilien
- Site de Marne La Vallée (MLV) : 2 – 4 cours de la Gondoire
77600 Jossigny
- Site de Meaux (MX) : 6/8 rue Saint Fiacre – 77104 Meaux
- Site de Coulommiers (CLM) : 4 Rue Gabriel Péri – 77120
Coulommiers
- Site Abel Le Blanc (ALB) : Avenue Victor Hugo 77120
Coulommiers
Forme juridique : Groupement de coopération sanitaire de moyens
(GCS).
-
3.2. Présentation du
laboratoire
Le laboratoire multisite de biologie médicale comporte 3 sites
(Meaux, Marne la Vallée, Coulommiers) réalisant des analyses. Le
4ème site (Hôpital Abel Leblanc) est une annexe du CH de Coulommiers
où sont réalisés les prélèvements pour les patients externes, il
sert également de centre de tri pour l’Hôpital Abel Leblanc. Le
laboratoire multisite de biologie médicale (LBM) forme avec le
service d’anatomopathologie le pôle biopathologie du Grand Hôpital
de l’Est Francilien, il assure une permanence 24 heures sur 24, 7
jours sur 7, couverte par au minimum un technicien présent en
permanence sur les 3 sites réalisant des examens d’analyse.
Pour la réalisation de ses missions, le laboratoire s’appuie sur les
fonctions support de l’hôpital : informatique, facturation, achat,
ressources humaines, technique, comptabilité, nettoyage, etc.
Les fonctions administration, finances, sécurité et informatique du
laboratoire sont gérés au niveau des pôles administratifs du GHEF.
Les prélèvements effectués en dehors du laboratoire et leur
transport peuvent être réalisés par des personnes extérieures au
service. Ces prélèvements et ce transport sont organisés de manière
à garantir :
- Le transfert de l’échantillon dans des délais et des
conditions de conservation adéquats.
- Le respect des conditions élémentaires d’hygiène et sécurité.
- Le respect de la confidentialité.
-
3.3. Les activités
d’analyse du laboratoire
Le laboratoire multisite de Biologie Médicale est composé de
plusieurs unités médicales réparties sur les trois (03) sites
hospitaliers :
- Biologie dont un secteur de Biochimie, un secteur
d’hématologie
- Hygiène hospitalière
- Site de Marne La Vallée :
- Qualité-Transversal
- Biochimie
- Hématologie-transfusion (avec dépôt de sang)
- Hygiène inter-hospitalière
- Microbiologie, subdivisée en 5 secteurs :
- Bactériologie
- Immunologie auto-immunité, parasitologie-mycologie et
allergologie
- Virologie, sérologie
- P3 pour mycobactéries
- Hygiène de l’environnement : qui traite notamment le
paramètre Légionelle.
- Biologie dont un secteur de Biochimie, un secteur
d’hématologie et un dépôt de sang.
-
3.4. Gestion des
équipements du laboratoire
Pour répondre au besoin d’une prestation de qualité aux patients,
l’ensemble des équipements du laboratoire doit faire l’objet d’une
gestion rigoureuse.
Pour ce fait dans notre cas ,le responsable de la métrologie est
chargé d’assurer la gestion des équipements et leur suivi
métrologique éventuel, sous la responsabilité du chef de service et
du responsable assurance qualité (RAQ), en collaboration avec les
biologistes médicaux et les techniciens de chaque unité médicale,
les cadres médico-techniques et le service biomédical. Un contrat
reparti la gestion des équipements entre le pôle biopathologie et le
pôle des ressources logistiques et technique, confère annexe 1.
- Réception de l’équipement
La réception de l’équipement est effectuée par le service biomédical
qui gère la documentation liée.
- Installation, confirmation métrologique initiale,
inventaire marquage
Installation / mise en service
L’installation du nouvel équipement s’effectue sous la
responsabilité du service biomédical, qui collecte auprès du
fournisseur toute information ou documentation nécessaire et
suffisante et s’assure que l’éventuelle confirmation métrologique
initiale est effectuée. Si le fournisseur assure lui-même
l’installation de l’équipement, un certificat d’installation devra
être délivré et archivé dans le dossier de l’équipement.
Lors de cette mise en service, un étalonnage ou une vérification
initiale devront être réalisés si nécessaire, afin de démontrer que
les performances attendues sont bien atteintes dans l’environnement
du laboratoire. Cette vérification s’appuiera sur des mesures
portant sur des échantillons de contrôle et/ou matériaux de
référence.
Le biologiste responsable de l’unité doit aussi vérifier au besoin
la cohérence des résultats obtenus, en regard des valeurs issues des
équipements similaires installés antérieurement.
Inventaire, identification univoque et marquage
L’équipement est introduit dans l’inventaire GMAO (Gestion de la
Maintenance Assistée par Ordinateur) du service biomédical, qui
procède à l’identification univoque et au marquage du nouvel
équipement.
L’équipement est également référencé dans l’inventaire de proximité
du laboratoire tenu à jour par le responsable de la métrologie.
- Elaboration de la documentation
Dossier d’équipement
Pour tout nouvel équipement, le responsable de la métrologie, en
collaboration avec le service biomédical et le responsable du
secteur concerné, créé un dossier d’équipement comprenant au minima
:
- La Fiche synoptique de l’équipement
- La Fiche de vie de l’équipement
- Le mode opératoire d’utilisation et de maintenance
- Le cahier des charges techniques
- Le devis, le bon de commande, bon de livraison
- L’attestation de garantie
- Les certificats d’étalonnage ou les constats de vérification
- Tout document technique utile se rapportant à l’équipement.
Ce dossier sera préférentiellement tenu sous forme de classeurs
(information et traçabilité), suivant les indications contenues dans
la procédure de gestion documentaire en vigueur.
- Formation et habilitation des utilisateurs
En collaboration avec le cadre médico-technique, les biologistes
médicaux définissent, mettent en place et évaluent les formations et
les modalités d’habilitation nécessaires.
- Etalonnage et contrôles, mise en production
Sous la responsabilité du biologiste responsable d’unité médicale,
le technicien (interne ou prestataire extérieur) met en service ou
en production le nouvel équipement, après avoir effectué
l’étalonnage et les contrôles nécessaires.
- Maintenances, gestion des dysfonctionnements et
non-conformités
Tous les équipements utilisés au sein du laboratoire font l’objet
d’un suivi régulier.
Un programme de maintenances est défini en collaboration avec le
biologiste responsable d’unité médicale et mis en œuvre par le
service biomédical ou le fournisseur, suivant les termes du contrat
de maintenance et suivant le type et le niveau d’intervention
requis.
Toutes les interventions sont enregistrées dans la GMAO et les
classeurs dédiés du laboratoire. Les bons d’interventions sont
archivés au sein des classeurs de traçabilité.
La gestion des dysfonctionnements et non-conformités est assurée par
le technicien, en collaboration avec les biologistes médicaux, le
cadre médico-technique et le responsable de la métrologie.
En cas de panne, la copie du bon d’intervention enregistré dans la
GMAO est collée sur l’équipement avec la mention « HORS SERVICE ».
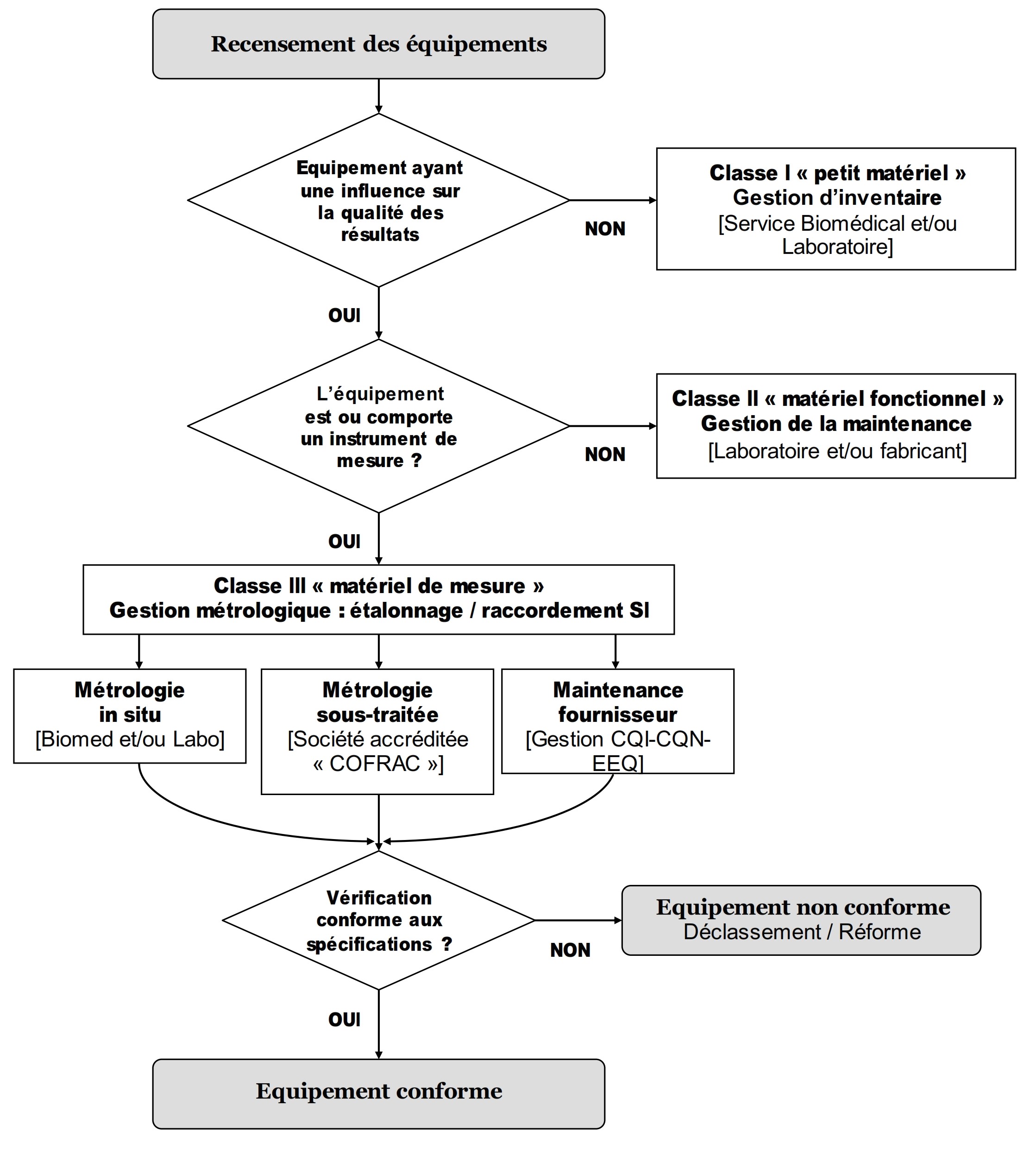
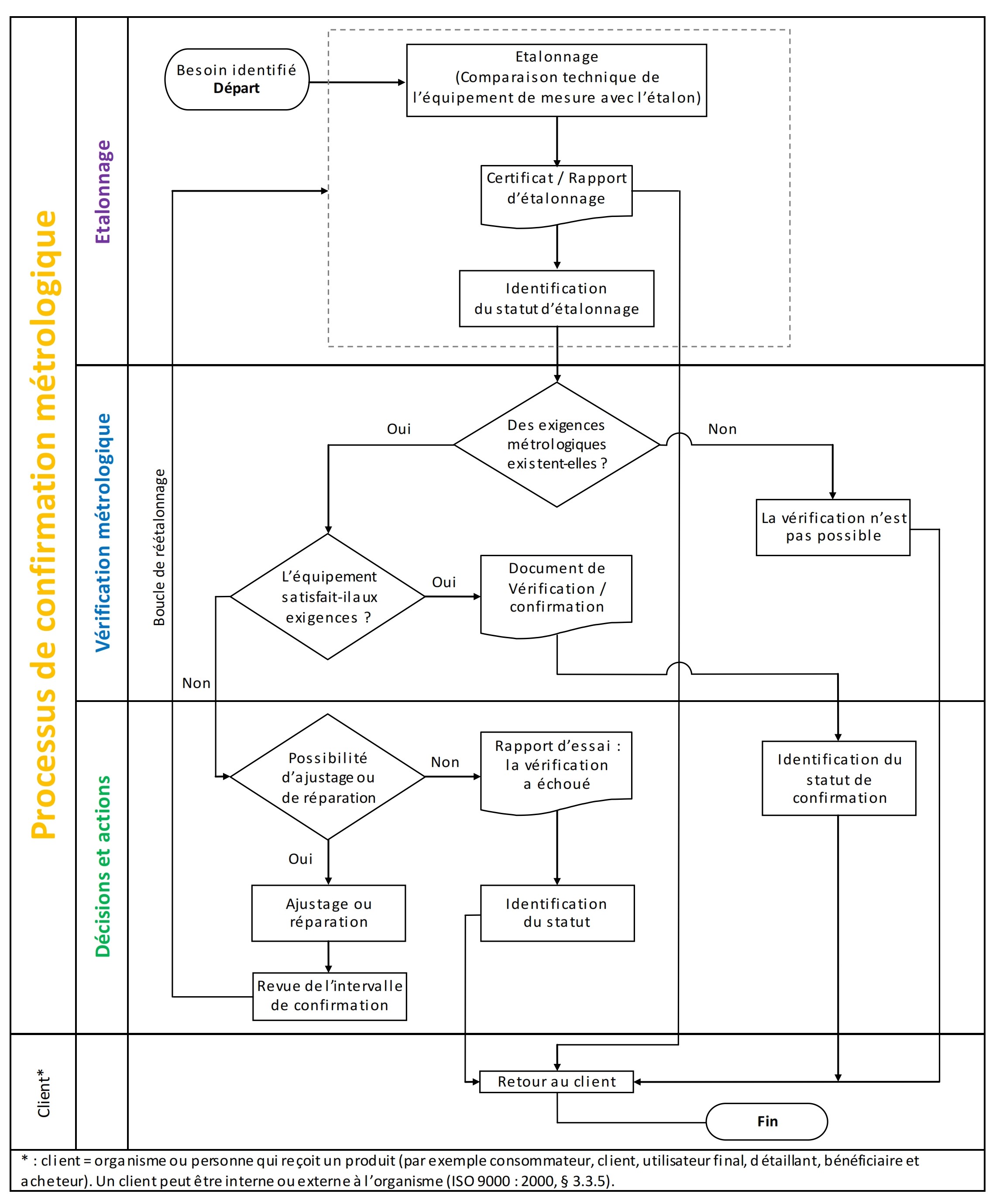
- Suivi et confirmation métrologique périodique éventuels
Les équipements faisant l’objet d’un suivi
métrologique sont déterminés selon le logigramme suivant
:
retour sommaire
Le laboratoire fait appel uniquement à des prestataires accrédités
afin d’assurer le raccordement métrologique de ses équipements.
Toute prestation de raccordement métrologique doit se traduire par
la remise d’un certificat d’étalonnage et/ou d’un constat de
vérification couvert par l’accréditation COFRAC.
Après étalonnage et/ou vérification, le responsable de la métrologie
est en charge d’assurer la confirmation métrologique, en
collaboration avec le biologiste responsable d’unité médicale. Cette
confirmation devra établir ou non la conformité de l’équipement en
fonction de son utilisation.
- Traçabilité de confirmation métrologique
Le responsable métrologique est chargé d’assurer la traçabilité des
décisions de confirmation métrologique.
Cette traçabilité est effectuée via divers fichiers Excel de suivi
des équipements critiques élaborés :
- pour l’ensemble du parc des équipements identifiés comme
critiques,
- et/ou pour les équipements d’un même secteur technique,
- et/ou pour les équipements traités par type (exemple :
pipettes de précision),
Dans ces fichiers figure une colonne intitulée « ETAT / CONCLUSION »
dans laquelle, pour chaque équipement, la 1ère ligne de cellule du
tableau reprend l’avis de conformité rendu par le prestataire sur le
constat de vérification ou d’étalonnage remis au LBM, et la 2nde
ligne de cellule du tableau indique la décision prise en interne à
l’issue de la démarche de confirmation métrologique opérée par le
responsable métrologie.
Le cas échéant, la traçabilité pourra être effectuée en parallèle
sur tout document de traçabilité propre à l’équipement (ex :
formulaire de traçabilité d’étalonnage des masses étalons ; fiche de
vie d’équipement, etc.). Schéma du processus de confirmation
métrologique confère annexe 2.
- Déclassement ou réforme de l’’équipement
Selon le type d’équipement et l’état d’usage, le biologiste
responsable d’unité médicale prononce le déclassement ou la réforme
de l’équipement, en collaboration avec le service biomédical, le
cadre médico-technique et le responsable de la
métrologie. Dans l’attente de l’enlèvement, est apposé
sur l’équipement la mention « HORS SERVICE ». L’inventaire du
service biomédical et l’inventaire de proximité du laboratoire,
ainsi que le dossier d’équipement sont alors mis à jour.
-
3.5. Les accréditations du
laboratoire
Une démarche d’harmonisation des pratiques et d’optimisation des
moyens humains et techniques a été planifiée par le laboratoire
multisite du GHEF pour permettre un engagement dans la démarche
d’accréditation. Un responsable assurance qualité (RAQ) a été nommé,
et une cellule qualité transversale a été mise en place pour
déployer un système d’assurance qualité commun aux 3 sites et
conforme aux exigences de la norme NF EN ISO 15189.
Localement, sur les sites, des cellules qualité locales ont aussi
été mises en place. La documentation qualité des 3 sites a été
harmonisée. Des formations de sensibilisation à l’assurance qualité
en biologie médicale et à l’audit ont été dispensées. Chaque site
dispose d’un titulaire du Diplôme Universitaire (DU) d’Assurance de
la Qualité en Biologie Médicale : le Dr Mourad BENDAOUD, RAQ à
Marne-la-Vallée, le Dr Agnès PAULZE – enseignante du D.U, à Meaux,
et Stéphane DEVILLERS - technicien référent qualité à plein temps et
responsable métrologie du GHEF, à Coulommiers.
Un programme d’audits internes est donc planifié, permettant
d’auditer divers processus qualité ou technique. Régulièrement des
audits externes indépendants sont également commandés auprès des
prestataires externes qualifiés, ce qui permet de préparer le LBM
aux audits conduits par le COFRAC suivant le référentiel NF EN ISO
15189.
En dehors des audits préparatoires réalisés par des prestataires
externes qualifiés, plusieurs audits COFRAC ont été conduits sur
tout ou parties des différents sites, ce qui a prévalu
l’accréditation du laboratoire de biologie médicale (LBM) du GHEF à
la norme NF EN ISO 15189 depuis juin 2014 sur 85% de ses analyses.
Certificat d’accréditation confère annexe 3.
Le tableau suivant présent le bilan des visites du Cofrac :
Biologie
médicale – Référentiel NF EN ISO 15189
NB : en biologie multisite, tout écart notifié et toute
accréditation décernée à l’issus de la visite de l’un des
sites vaut pour l’ensemble des sites du LBM
|
1ère visite : juin
2014
|
Le COFRAC a audité les sites de Coulommiers
(Pré analytique et antenne de prélèvements) et Meaux
(Hémostase) ; 17 écarts ont été notifiés, dont 2
critiques
|
2nde visite : juillet 2015
|
L’audit a permis de vérifier que les écarts
ont été corrigés. Le COFRAC a audité les sites de Meaux
(Hématologie Cytologie et Hémostase) et Marne-la-Vallée
(Biochimie
générale et spécialisée ; Pharmacologie Toxicologie) ; 15
écarts ont été notifiés, dont 2 critiques et 13 non
critiques, ainsi que 2 axes d’améliorations
|
3ème visite : juillet 2016
|
L’audit a permis de vérifier que les écarts
ont été corrigés. Le COFRAC a audité les sites de
Marne-la-Vallée (Sérologie infectieuse) et Meaux (Biochimie
et Pharmacotoxicologie) ;
6 écarts non critiques ont été notifiés.
L’accréditation n°8-3892 a été obtenu le 18/10/2016
(certificat et portée d’accréditation consultables sur le
site du COFRAC)
|
La diminution progressive du nombre d’écarts critiques et non
critiques notifiés par le COFRAC traduit l’approfondissement de la
mise en œuvre des exigences des référentiels et l’adéquation du
système d’assurance de la qualité du GHEF.
-
3.6. Impacts du
regroupement des trois sites sur le laboratoire
Le rapprochement des trois sites est une réussite dans la démarche
d’accréditation du laboratoire dans le sens qu’il permet :
- Une harmonisation des pratiques sur les trois sites
- D’accréditer une seule paillasse au lieu de trois
- Du point de vue économique il est intéressant car la visite du
Cofrac s’effectue sur un seul site et le résultat est valable
pour les autres sites.
-
Contexte
et attendus de l’étude
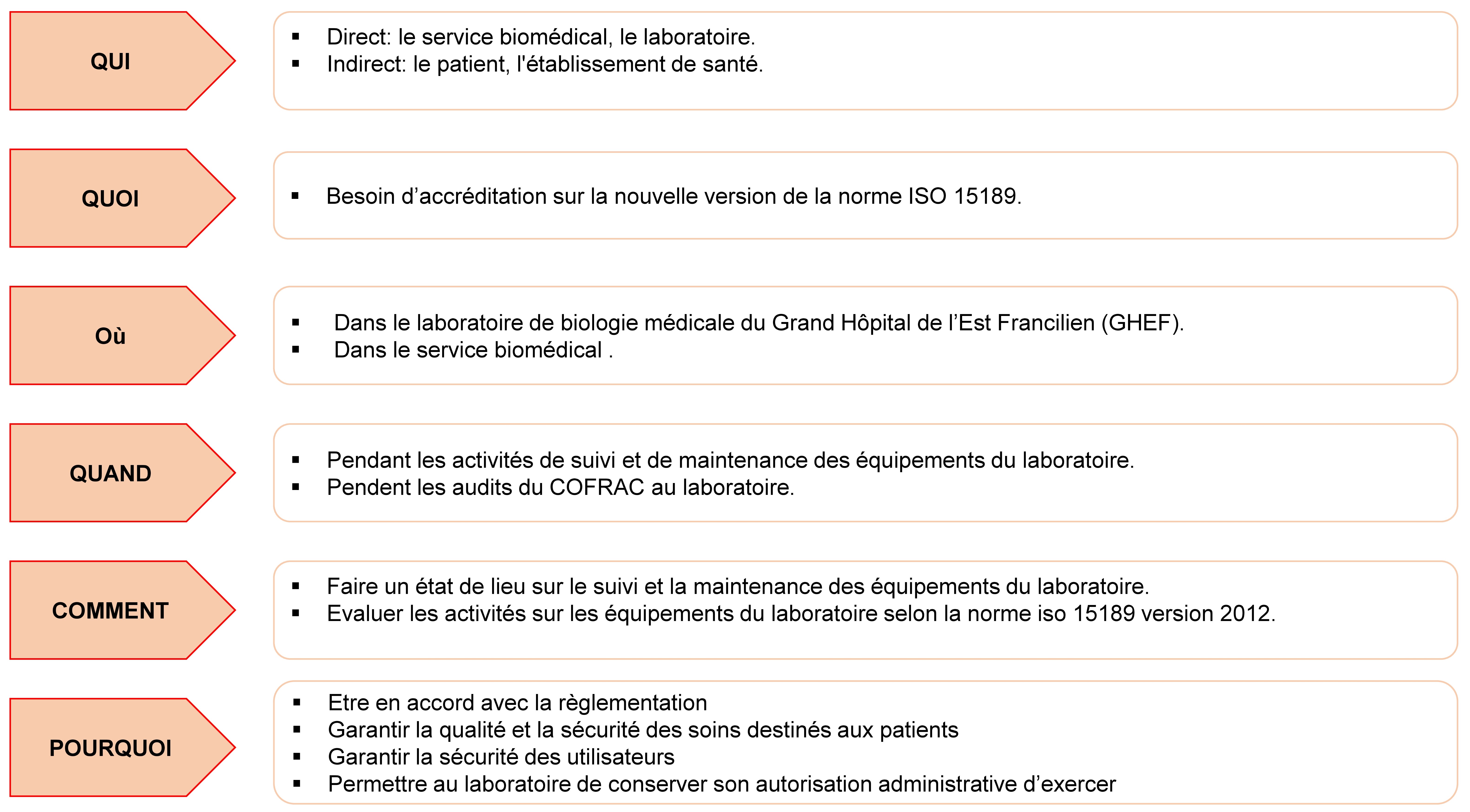
Nous avons utilisé la méthode QQOQCP (Qui, Quoi, Où, Quand, Comment,
Pourquoi) afin de récolter des informations précises et exhaustives
sur la situation du laboratoire et d’en mesurer le niveau
d’importance.
Cette analyse s’est déroulée de la manière suivante :
A la suite de ces réponses nous avons pu cadrer la situation de la
manière suivante :
Besoin
Dans le cadre de la transition du laboratoire de la version 2007
vers la version 2012 de la norme NF EN ISO 15189 prévu en juillet
2017, le service biomédical étant un des acteurs en charge des
équipements du laboratoire souhaite faire une évaluation sur la
gestion des équipements du laboratoire selon la norme NF EN ISO
15189 : 2012, afin d’agir sur des éventuels écarts.
Enjeux
Cette évaluation permettra d’anticiper les écarts sur la gestion des
équipements à l’issue duquel le laboratoire pourra être accrédité.
Ce qui permettra :
- D’être en phase avec la règlementation.
- D’avoir une bonne perception de l’image de l’hôpital.
- D’avoir une meilleure optimisation du budget de maintenance
- Garantir une meilleure qualité de soins pour le patient
- D’avoir une amélioration dans le suivi et de la maintenance
des équipements
Objectifs
- Mettre en place un outil d’évaluation de la gestion des
équipements basé sur la norme NF EN ISO 15189 / 2012.
- Evaluer les activités de suivi, maintenance, traçabilité,
métrologie et d’étalonnage des équipements du laboratoire en se
basant sur le référentiel d’accréditation (NF EN ISO 15189 :
2012) des évaluateurs du COFRAC.
- Tirer des conclusions de l’évaluation et proposer des plans
d’actions adaptés aux écarts constatés.
-
EVALUATION
DU LABORATOIRE DU GHEF
-
L’outil
d’évaluation
-
1. Présentation
Pour analyser les données reçues, il a été fondamental pour nous
d’être le plus objectif possible. Pour ce fait nous avons développé
sur un tableur Excel, une grille d’analyse basé sur la NF EN ISO
15189 : 2012, qui permet d'évaluer la conformité des activités de
suivi et de maintenance des équipements du laboratoire de biologie
médicale.
-
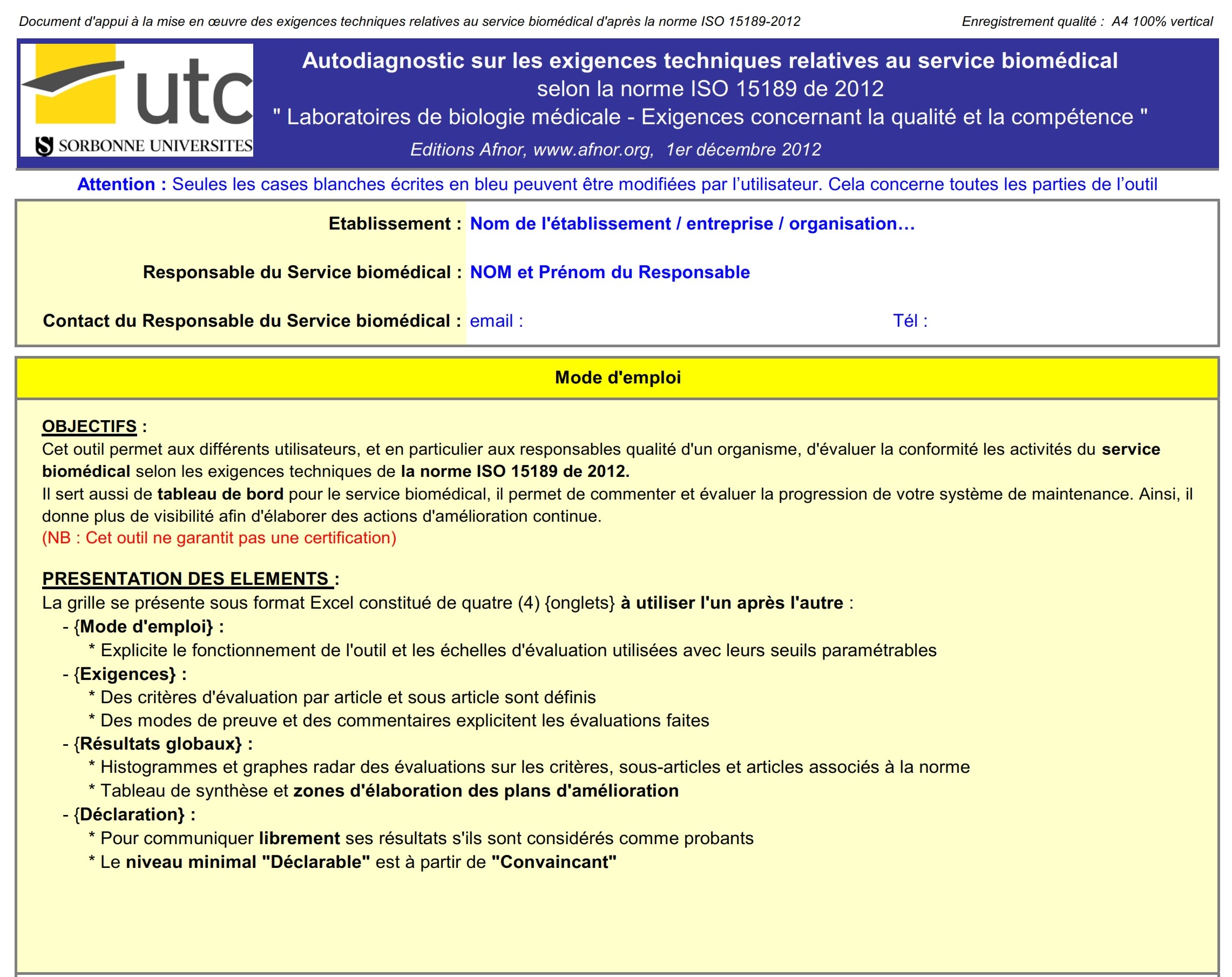
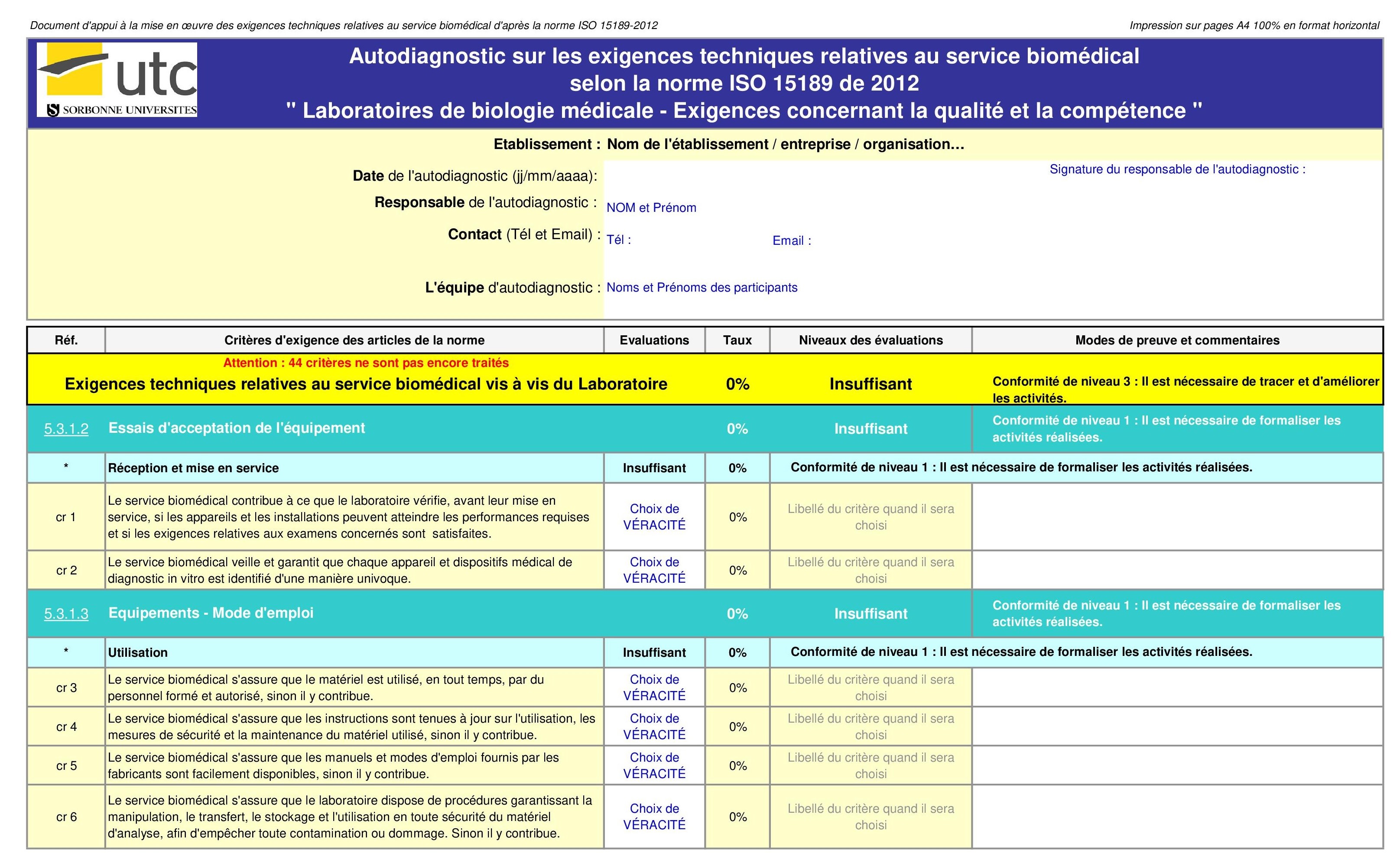
2. Fonctionnalité
La grille se présente sous format Excel constitué de quatre (4)
{onglets} à utiliser l'un après l'autre :
- Mode d'emploi : cette partie fat une présentation de
l’outil d’évaluation, son objectif et son mode fonctionnement.
- Exigences : c’est la partie qui permet d’introduire
les données qui seront utilisées pour évaluer la gestion des
équipements du laboratoire.
- Des critères d'évaluation par article et sous article y
sont définis
- Des modes de preuve et des commentaires explicitent les
évaluations faites.
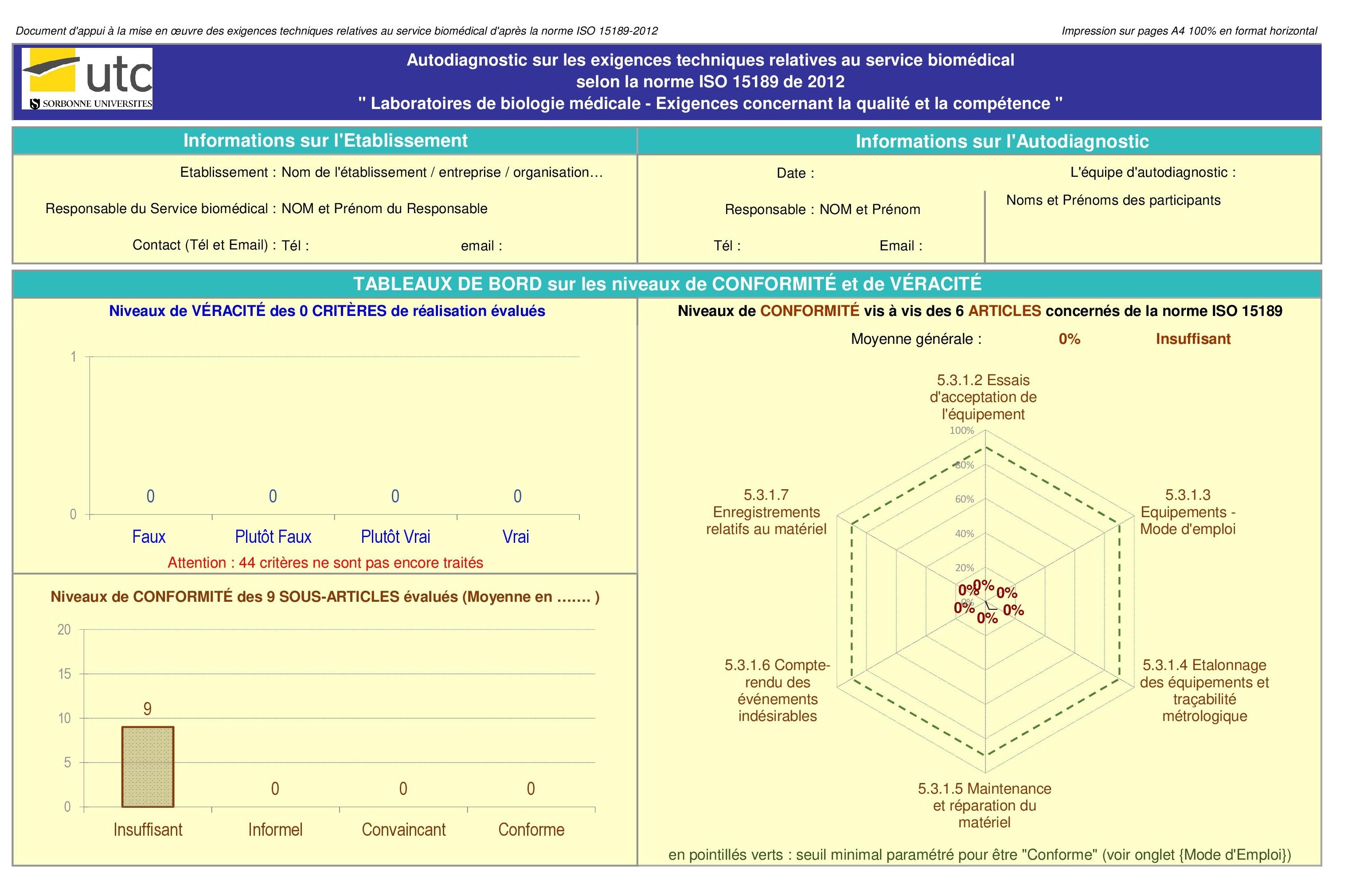
- Résultats globaux : c’est la partie qui permet de
visualiser graphiquement le niveau de conformité des données
introduit par l’utilisateur, elle se présente sous forme :
- Histogrammes et graphes radar sur les critères,
sous-articles et articles associés à la norme iso 15189 /2012
- Tableau de synthèse et zones d'élaboration des plans
d'amélioration
|
|
(créer par le stagiaire)
|
- Déclaration : cette partie permet de communiquer
librement les résultats s'ils sont considérés comme probants.
Lorsque le taux moyen est de :
- 0 à 29% : le niveau de conformité est insuffisant
- 30 à 59% : le niveau de conformité est informel
- 60 à 89% : le niveau de conformité est convaincant
- 90 à 100% : le niveau de conformité est conforme
Le niveau minimal "Déclarable" est à partir de "Convaincant"
-
Déroulement
de l’étude, entretiens préalables et recueille des données
Afin d’obtenir des données fiables pour notre évaluation, nous avons
été en collaboration avec les responsables dans la gestion du parc
du laboratoire :
- Dr Mourad BENDAOUD Chef du pôle biopathologie du territoire
et Responsable Assurance Qualité du laboratoire multisite
- Mme. Laurence PAINT Cadre du laboratoire site marne-la-vallée
- M. Stéphane DEVILLERS Responsable métrologie du laboratoire
- L’ensemble du service biomédical.
Pendant cette collaboration, des entretiens ont été réalisés ; d’une
part pour recueillir des informations sur les activités de
maintenance, d’autre part pour comprendre le fonctionnement du
laboratoire afin de se faire un premier avis sur le degré de
confiance sur la gestion des équipements.
A l’issu de ces entretiens un check-list (basé sur la NF EN ISO
15189 : 2012) a été remplie par les différents responsables de suivi
et de maintenance des équipements du laboratoires.
Ensuite en collaboration avec le service biomédical et le métrologue
nous avons vérifié l’existence des documents qui attestent que les
données reçues sont authentiques. Les documents de preuve étaient
entre autres :
- Les fiches synoptiques des équipements
- Les fiches de vie des équipements
- Les certificats d’étalonnage ou les constats de vérification
- Les activités de maintenance planifiée et la preuve de leur
exécution dans la GMAO
- Etc.
-
Bilan
de l’évaluation
Pour finaliser notre étude nous avons introduit les données
collectées dans l’outil d’analyse ce qui nous a donné le résultat
suivant :
-
1. Déclaration
de conformité selon la norme NF EN ISO 17050
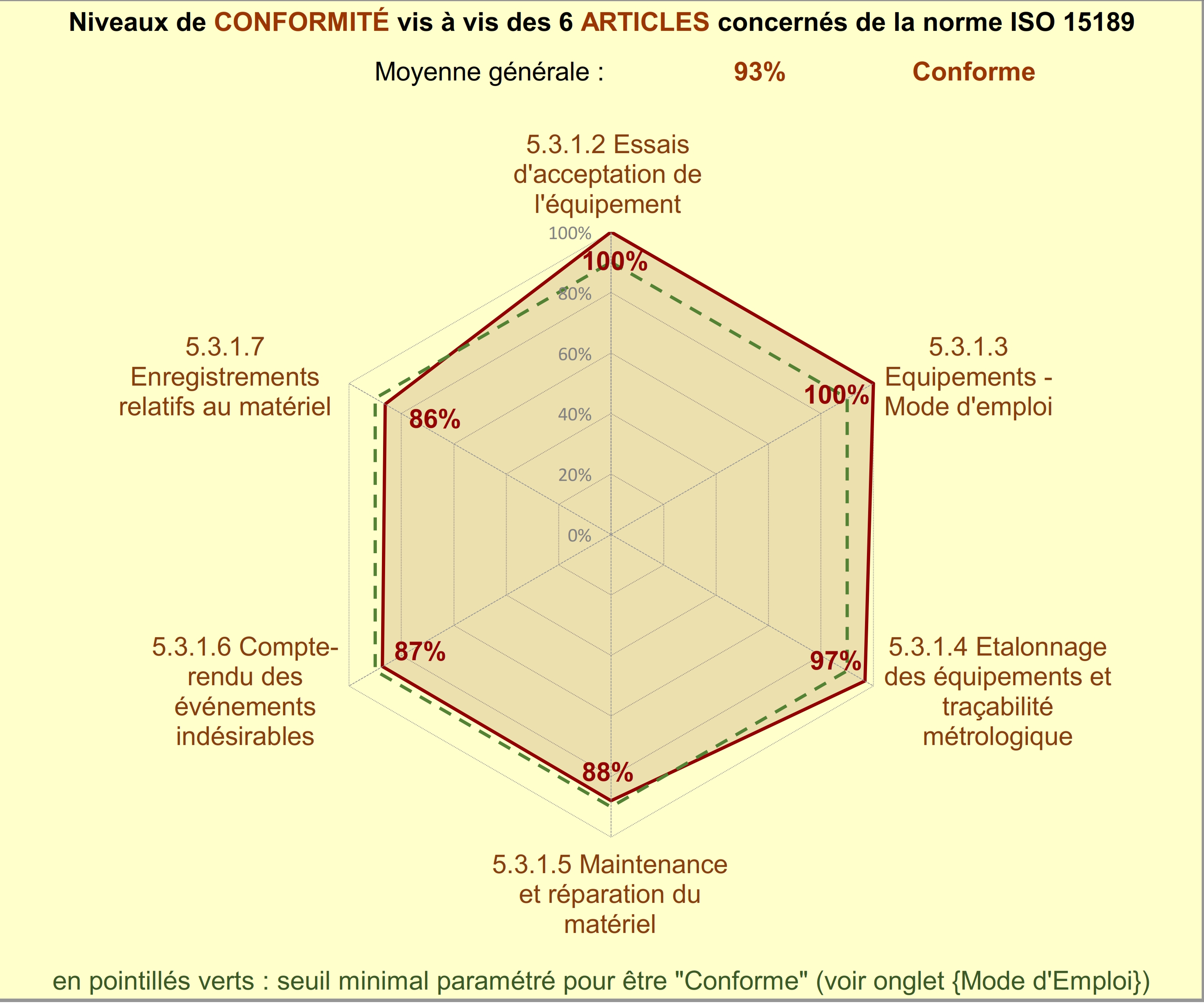
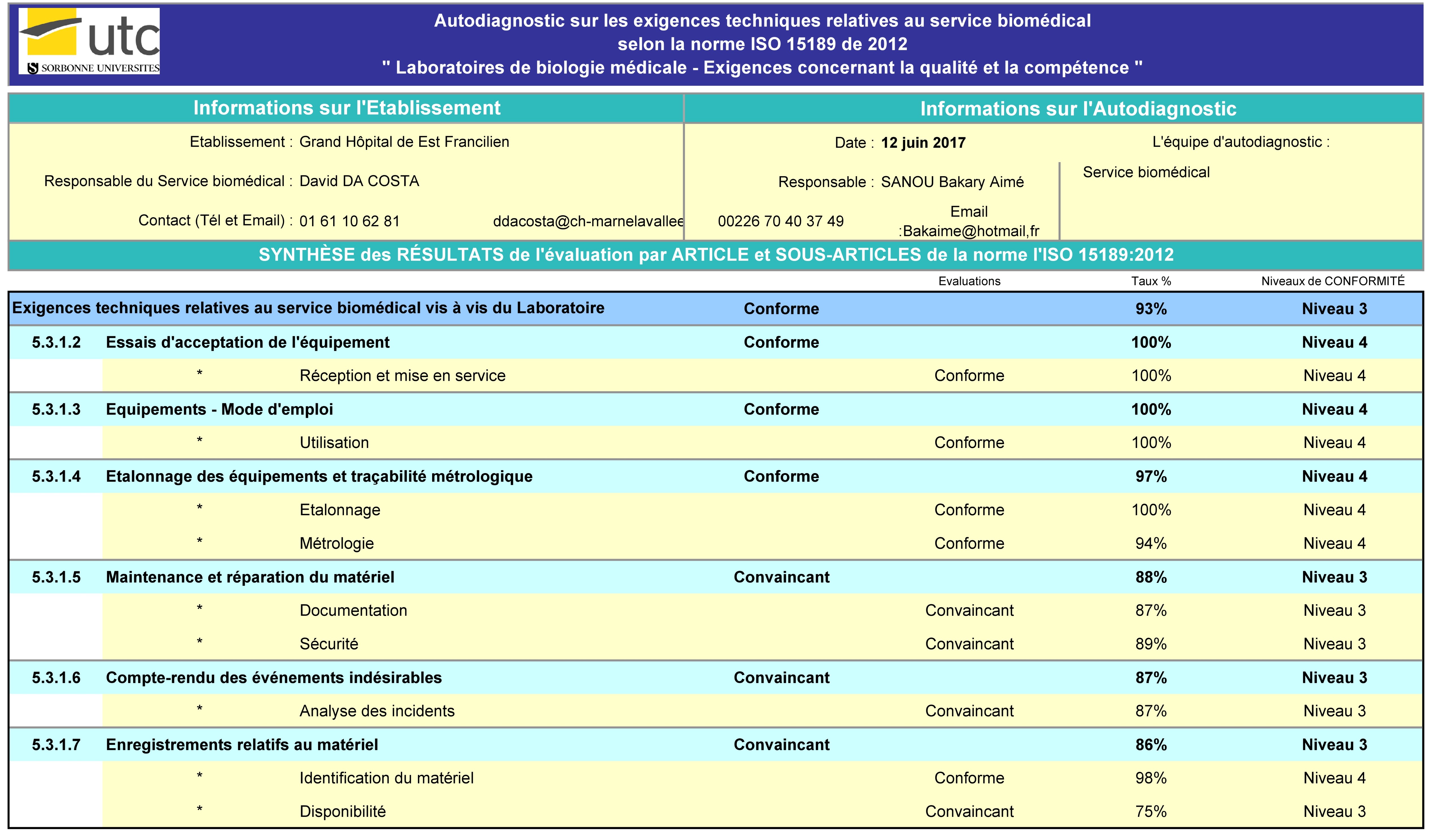
Selon le résultat obtenu à l’issu de cette évaluation la gestion des
équipements du laboratoire multisite est conforme aux exigences de
la norme iso 15189 /2012 à un taux de 93% ce qui n’est pas largement
parfait quand on sait que le niveau conforme commence à partir de
90%. Cette évaluation fait également paraitre certains points
pouvant être toujours améliorés, dans la suite de notre travail nous
allons les analysés afin de faire des propositions d’améliorations.
-
2. Analyse des résultats
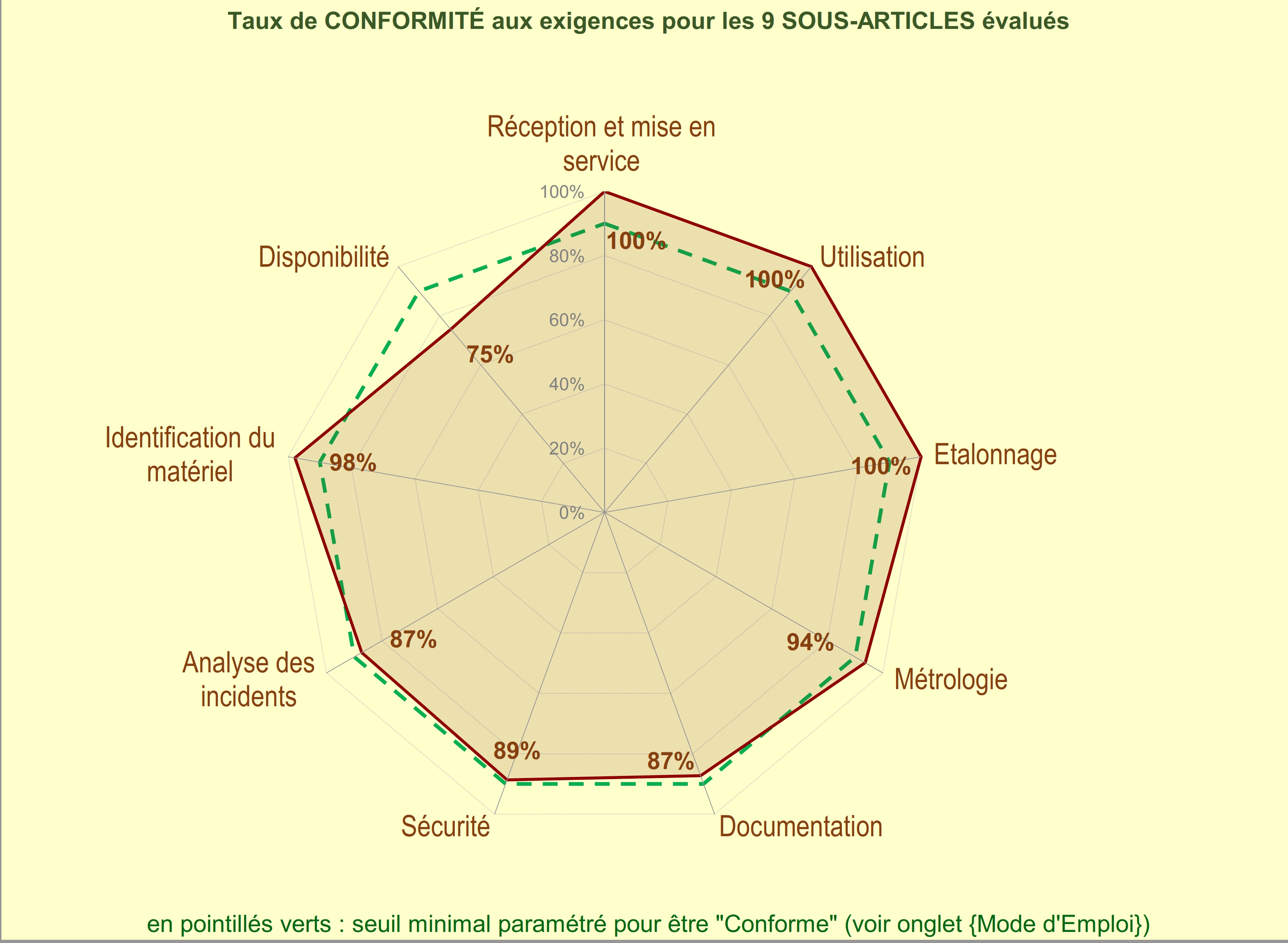
A partir des graphes et de la synthèse générées par l’outil
d’évaluation nous pouvons constater qu’un certain nombre d’article
peuvent être amélioré notamment :
Etalonnage des équipements et leur traçabilité métrologique :
- Métrologie
- Maintenance et réparation du matériel
- Documentation
- Sécurité
- Compte rendu des évènements indésirable
- Analyse des incidents
- Enregistrements relatifs au matériel
- Identification du matériel
- Disponibilité
Après avoir procédé à une vérification des exigences qui composent
ces points cités ci-dessus, nous avons énumérer des recommandations
pouvant les remettre au niveau conforme vis-à-vis de la norme iso
15189 / 2012.ensuite nous avons mis en place un système
d’amélioration continue (Cycle CAPD= Check, Act, Plan, Do).
-
RECOMMANDATIONS
EVOLUTIVES VALIDEES
-
Recommandation
sur les activités non conformes
Après avoir vérifié les textes qui composent les sous- articles non
conforment, nous avons fait des recommandations suivantes afin de
pallier à la situation :
- Etalonnage des équipements et leur traçabilité
métrologique :
- Métrologie : Analyser la traçabilité métrologique portant
sur un matériau ou une procédure de référence.
- Maintenance et réparation du matériel :
- Documentation : Analyser si le programme de maintenance
observe au minimum les instructions des fabricants.
- Sécurité : Faire connaitre le dispositif d'arrêt d'urgence
à tout le personnel.
- Analyse des incidents : Identifier et étudier les incidents
et les accidents pouvant être attribués directement à du
matériel spécifique.
- Enregistrements relatifs au matériel :
- Identification du matériel : Conserver les enregistrements
qui ont confirmé l'aptitude initiale du matériel ou de
l'équipement à l'utilisation.
- Disponibilité : Vérifier que les enregistrements soient
facilement accessibles lors de l'exploitation du matériel.
-
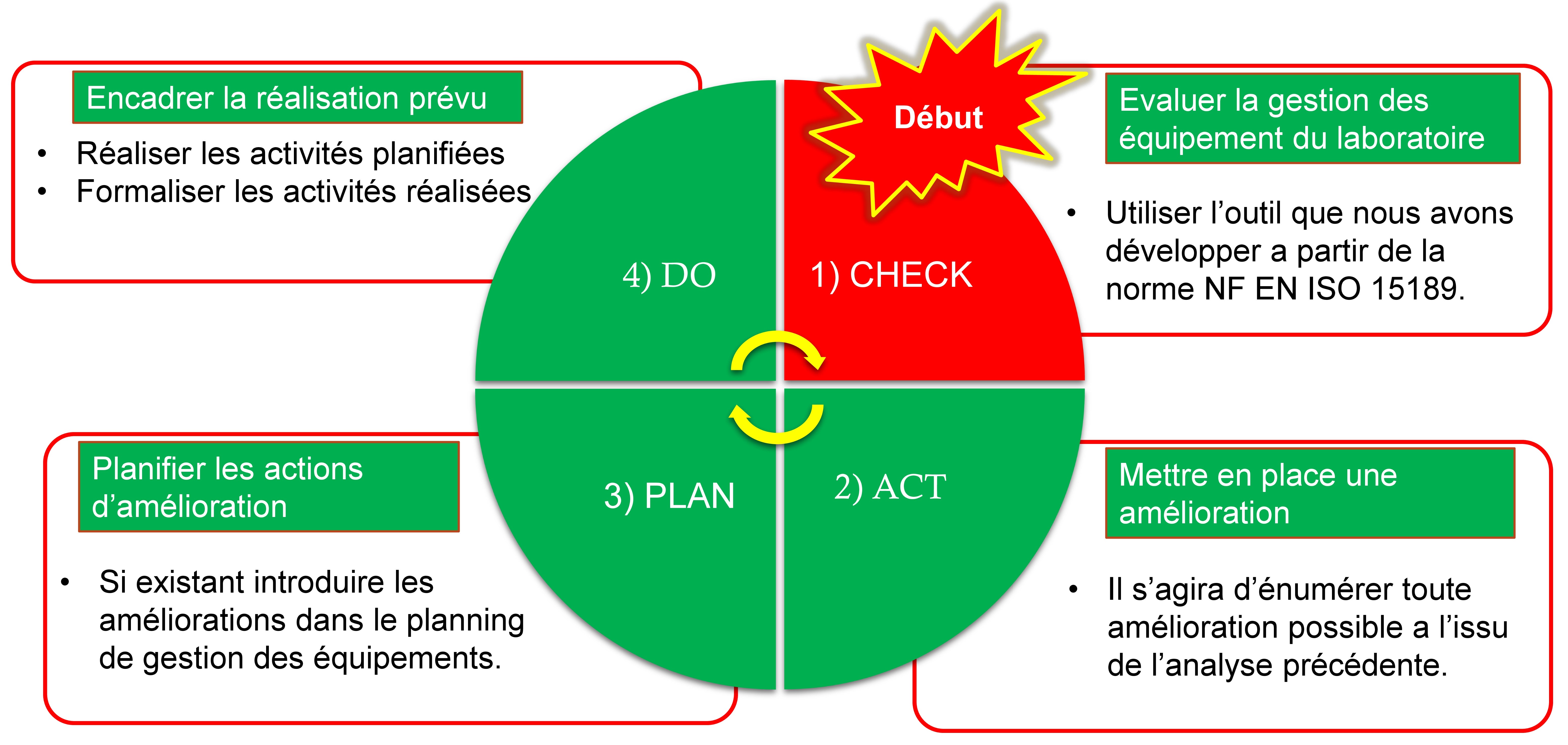
Mise en
place d’un système stratégique d’amélioration continue
La perfection étant un élément qui n’est jamais atteint, nous
essayons de nous en approcher le plus possible en proposant un cet
outil (CAPD), en retenant que l’amélioration des processus est
quelque chose qui ne finit jamais, qui est sans fin. Cette activité
devra se faire chaque trois (3) mois avant la visite d’accréditation
du Cofrac.
Notre outil se présente comme suit :
- Mesurer pour progresser => Check
- Imaginer les améliorations => Act
- Planifier les actions à réaliser => Plan
- Réaliser ce qui a été prévu => Do
Stratégie d’amélioration continue (cycle CAPD)
-
ACTIVITES
CONNEXES
La bonne gestion de la maintenance des dispositifs médicaux est un
élément essentiel à la vie d’un établissement de santé, notamment
dans le cadre de la continuité de fonctionnement des services avec
une meilleure prise en charge du patient. Pour parvenir à satisfaire
ce besoin le service biomédical a mis en place une organisation
permettant de maintenir le parc équipements de l’hôpital dans un bon
état de fonctionnement et conforme aux règlementations en vigueur.
Ce système d’organisation est piloté par une GMAO (Gestion de la
Maintenance Assistée par Ordinateur) qui permet de maîtriser et
d'enregistrer les opérations de maintenance, de contrôles qualité et
de contrôle de sécurité des dispositifs médicaux.
-
Gestion
de la Maintenance Assistée par Ordinateur (GMAO)
Le service biomédical utilise le progiciel Axel Maint 100 % web pour
la gestion de ses activités maintenance et d'optimisation. Les
activités quotidiennes du service biomédical sur la GMAO (Gestion de
la Maintenance Assistée par Ordinateur) :
- Elaboration et suivi du registre de sécurité, qualité et
maintenance (RSQM).
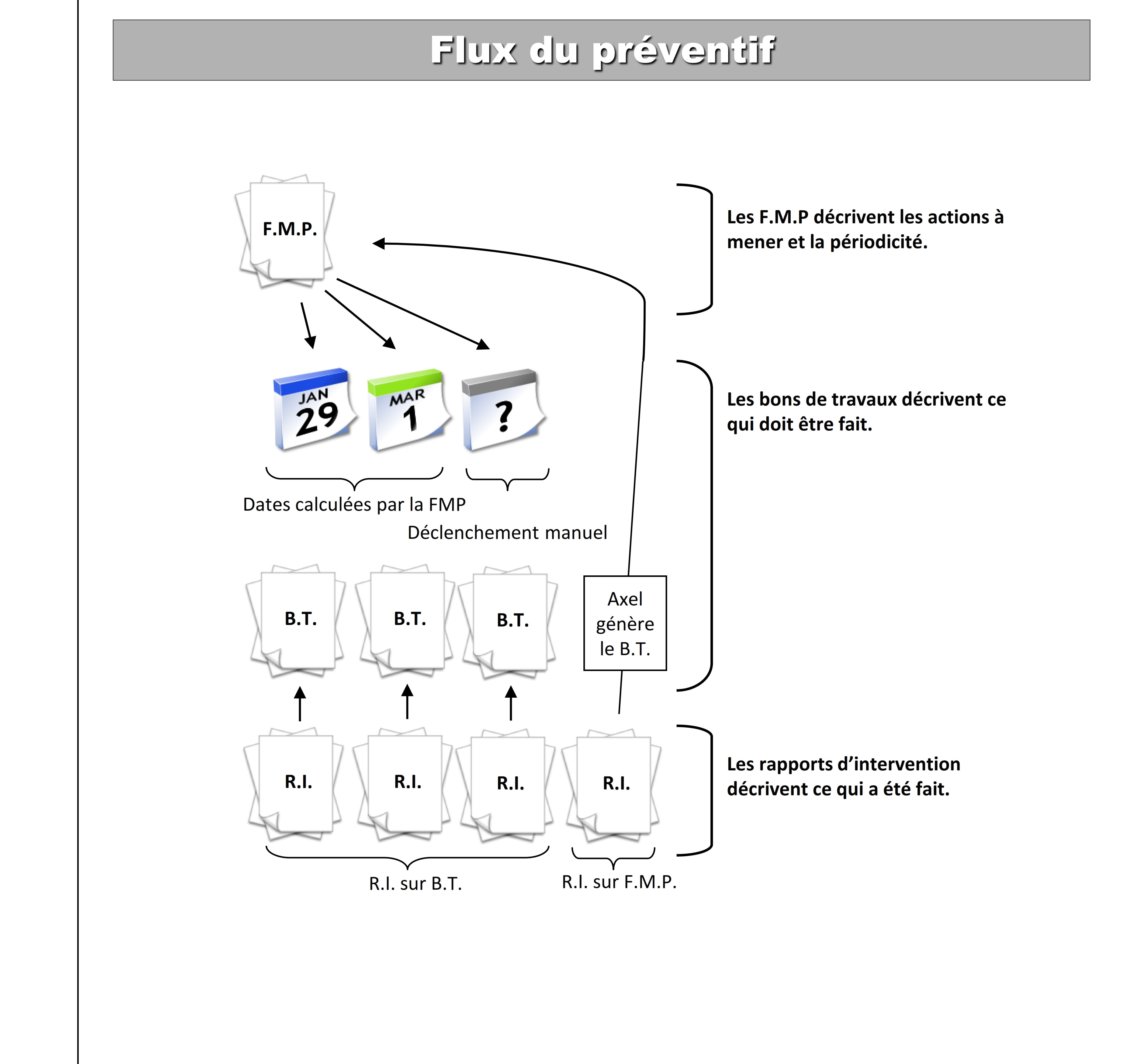
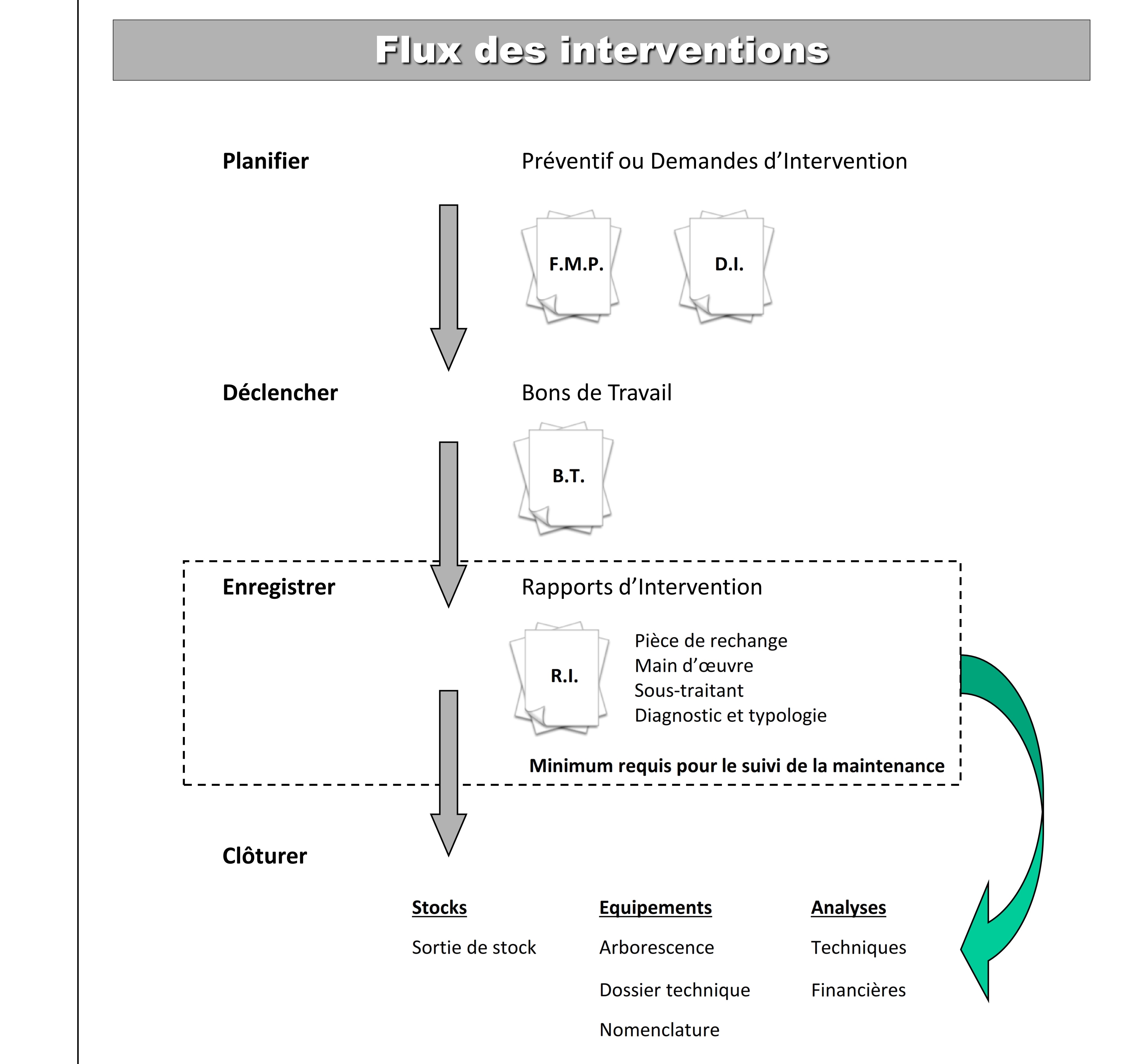
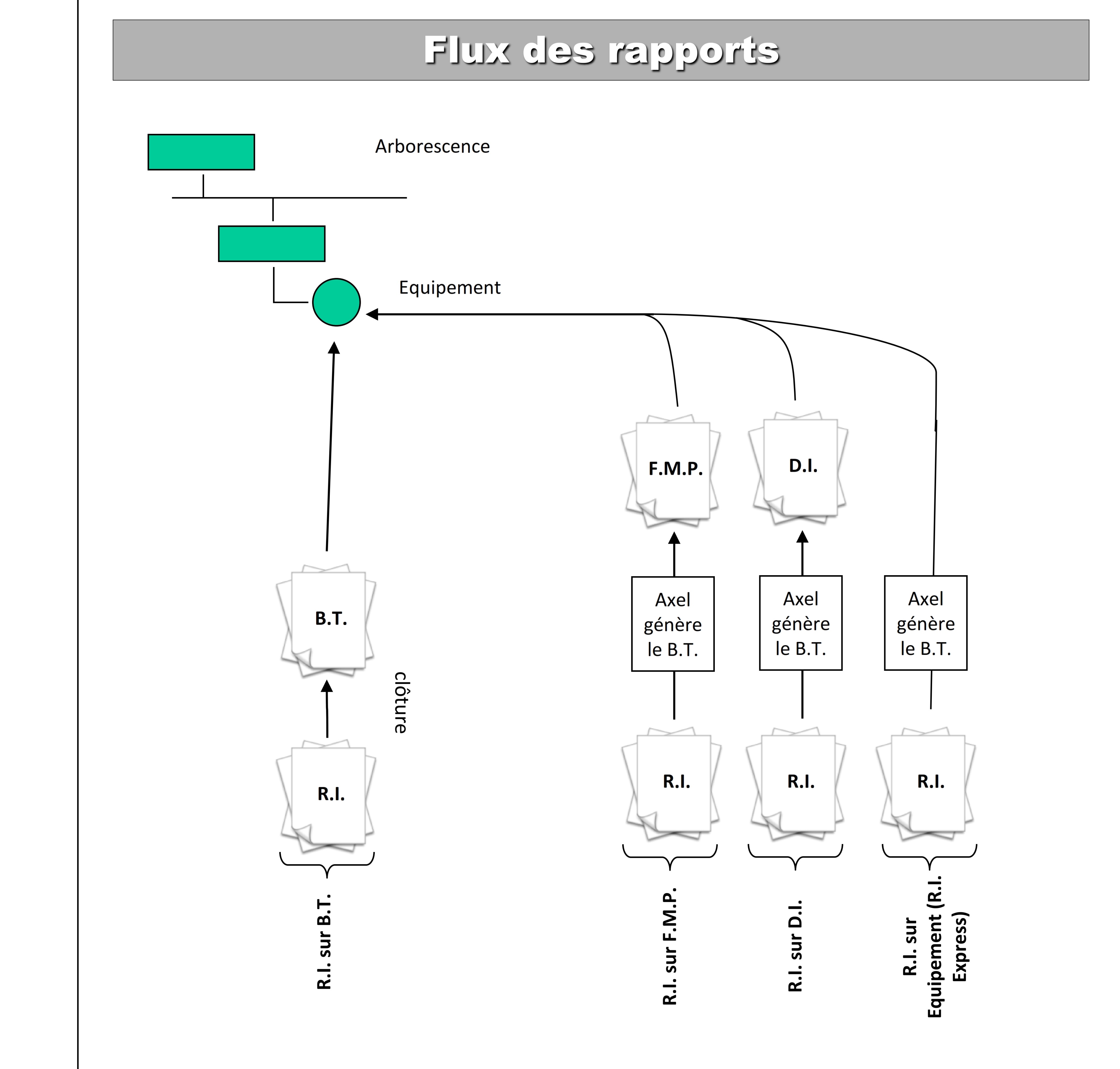
- Transformation des fiches de maintenance préventive (F.M. P)
en bon de travail
- Transformation des demandes d’intervention (D. I) en bon de
travail (B. T).
- Exécution des activités des bons de travaux (B.T).
- Enregistrement des rapports d’interventions (R. I).
- Clôture des bons de travaux (B.T).
Pour plus de détails confère annexe 4, annexe 5, annexe 6.
-
La
maintenance des équipements biomédicaux
Dans la mission d’exécution des activités des bons de travaux, nous
avons passés une partie du temps à faire des maintenances
préventives, des contrôles de sécurité électriques et des
vérifications des performances (contrôle qualité) sur les
équipements suivants :
- Pompes à perfusion
- Pousse seringue
- Bases de pousse seringue
- Moniteur de surveillance
- Couveuses
-
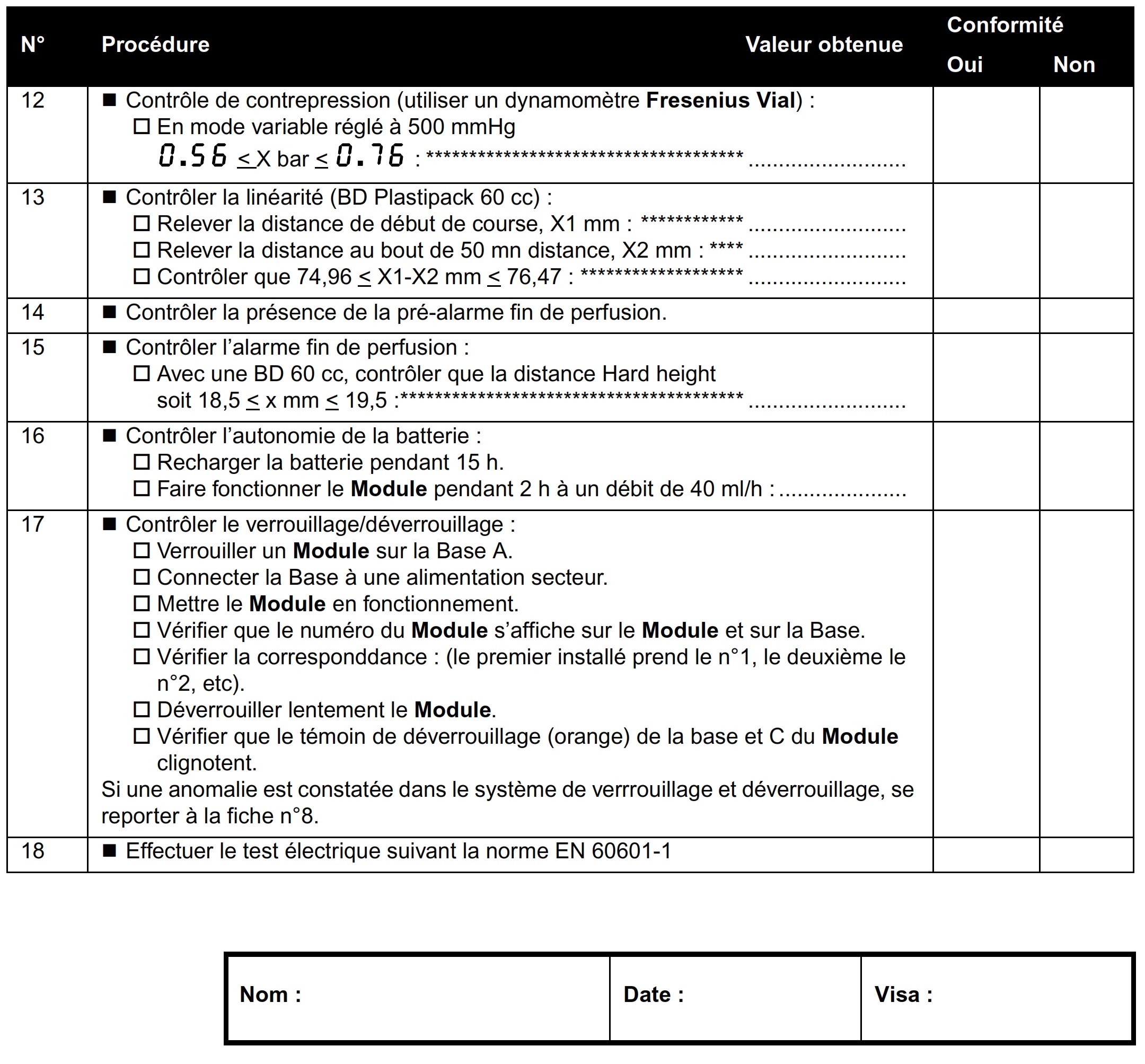
Exemple de cas de procédure de contrôle qualité :
- Contrôle qualité d’un pousse seringue module DPS.
Un contrôle qualité (non inclus dans le cadre de la garantie) est
effectué tous les 12 mois sur cet équipement, elle consiste en
différentes opérations d’inspections définies dans le Manuel
Technique de l’appareil. Il doit être effectué à l’aide de logiciels
développés par Fresenius-Vial (le constructeur de l’équipement).
Au départ l’équipement doit être connecté à l’ordinateur et
synchronisé avec le logiciel de contrôle qualité, ensuite on
renseigne l’identité de l’équipement et celle l’opérateur du
contrôle. Après la validation de ces informations le logiciel guide
l’opérateur sur les contrôles a effectué, chaque étape est validée
conforme ou non sur le logiciel par l’opérateur. A la fin un
certificat de contrôle qualité est généré par le logiciel. Ensuite
l’équipement est soumis à un contrôle électrique pour permettre de
valider qu’il répond aux exigences de la norme NF EN 62353 pour
aboutir à la sécurité électrique du patient. (exemple de certificat
de contrôle qualité avec les paramètres contrôlés annexe 7).
retour sommaire
-
CONCLUSION
GENERALE
Ce stage a été très enrichissant pour moi car il m’a permis de
découvrir dans le détail le secteur du biomédical, ses missions,
contraintes… et il m’a permis de participer concrètement aux enjeux
du secteur au travers de mes missions variées comme celle de
l’évaluation de la gestion des équipements du laboratoire, que j’ai
particulièrement apprécié pour son volet règlementaire qui fait
comprendre les raisons de chaque détail technique exigé pendant la
gestion des équipements ; toutes ces exigences ont pour but de
maintenir les équipements d’une manière efficace et efficient afin
de garantir des soins de qualités pour le patient.
Ce stage m’a aussi permis de comprendre que les missions du service
biomédical ne se limitent pas aux équipements mais que la
collaboration avec le personnel soignant est une mission d’une haute
importance.
L’hôpital qui m’a accueilli pendant ce stage fait face à une période
très importante qui est la fusion des centres hospitaliers, et je
suis très fier d’avoir pu participer à cette révolution. La fusion
des centres hospitaliers est un bouleversement, qui au-delà de ces
objectifs budgétaires, permettra, grâce au travail en réseaux, une
meilleure coordination sur l’ensemble des territoires avec des
avantages dans la démarche d’accréditation du laboratoire de
biologie médicale.
A travers cette étude nous avons pu :
- Créer un outil d’évaluation qui permettra au service
biomédical d’évaluer périodiquement la gestion des équipements
du laboratoire chaque trois (03) mois avant la visite de
certification ISO 15189 / 2012.
- Evaluer la gestion des équipements du laboratoire et proposé
des solutions pour remédier aux écarts constatés.
- Proposer une stratégie d’approche processus (Cycle
d’amélioration continue) qui permettra d’améliorer en continue
la gestion des équipements du laboratoire de biologie médicale.
Fort de cette expérience, j’aimerai beaucoup par la suite essayer de
m’orienter via des formations dans le secteur du laboratoire
notamment dans la gestion du parc équipements des laboratoires de
biologies médicales.
-
BIBLIOGRAPHIE
[1] LOI n° 2009-879
du 21 juillet 2009, Article 69 portant réforme de l'hôpital et
relative aux patients, à la santé et aux territoires (HPST).
https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000020879475.
Consulté le 10/05/2017.
[2] LOI n° 2013-442
art. 4, code santé publique Article L6221-1, Article L6211-2 du 30
mai 2013 portant réforme de la biologie médicale.
https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000027478077.
Consulté le 10/05/2017.
[3] NF EN ISO 15189
: 2012 – Laboratoires d’analyse de biologie médicale - Exigences
particulières concernant la qualité et la compétence – AFNOR.
[4] NF EN ISO 22870
: 2006 – Analyses de biologie délocalisée - Exigences concernant la
qualité et la compétence – AFNOR.
[5] Ordonnance n°
2010-49 du 13 janvier 2010, relative à la biologie médicale – JORF
15-01-2010.
https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000021683301&categorieLien=id
.Consulté le 18/05/2017.
[6] Arrêté du 26
avril 2002 modifiant l'arrêté du 26 novembre 1999 relatif à la bonne
exécution des analyses de biologie médicale (GBEA).
https://www.legifrance.gouv.fr/affichTexte.do?cidTexte=JORFTEXT000000580061&dateTexte=20170625.
Consulté le 22/05/2017.
[7] Présentation du
Grand hôpital de l’Est Francilien .
http://www.coulommiers.ghef.fr/le-ghef/le-ghef/ consulté le
30/05/2017.
[8] Rapport de
stage << réalisation d’un programme d’achat
commun aux trois centres hospitaliers du ghef>> TRAORE
Ibrahima Vincent, Certification Abih 2016, Université de Technologie
de Compiègne.
http://www.utc.fr/tsibh/public/3abih/16/stage/traore/index.html.
Consulté le 10/05/2017.
-
ANNEXES (source :
document interne du GHEF)
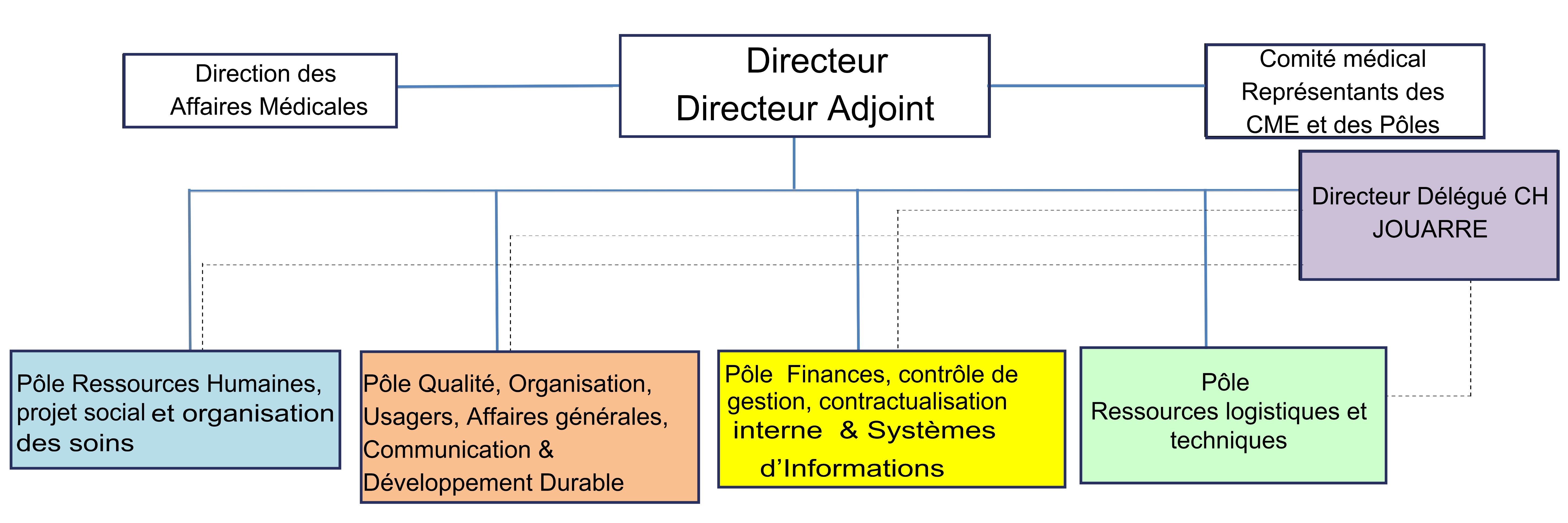
Annexe 1 : Répartition
de la gestion des équipements.
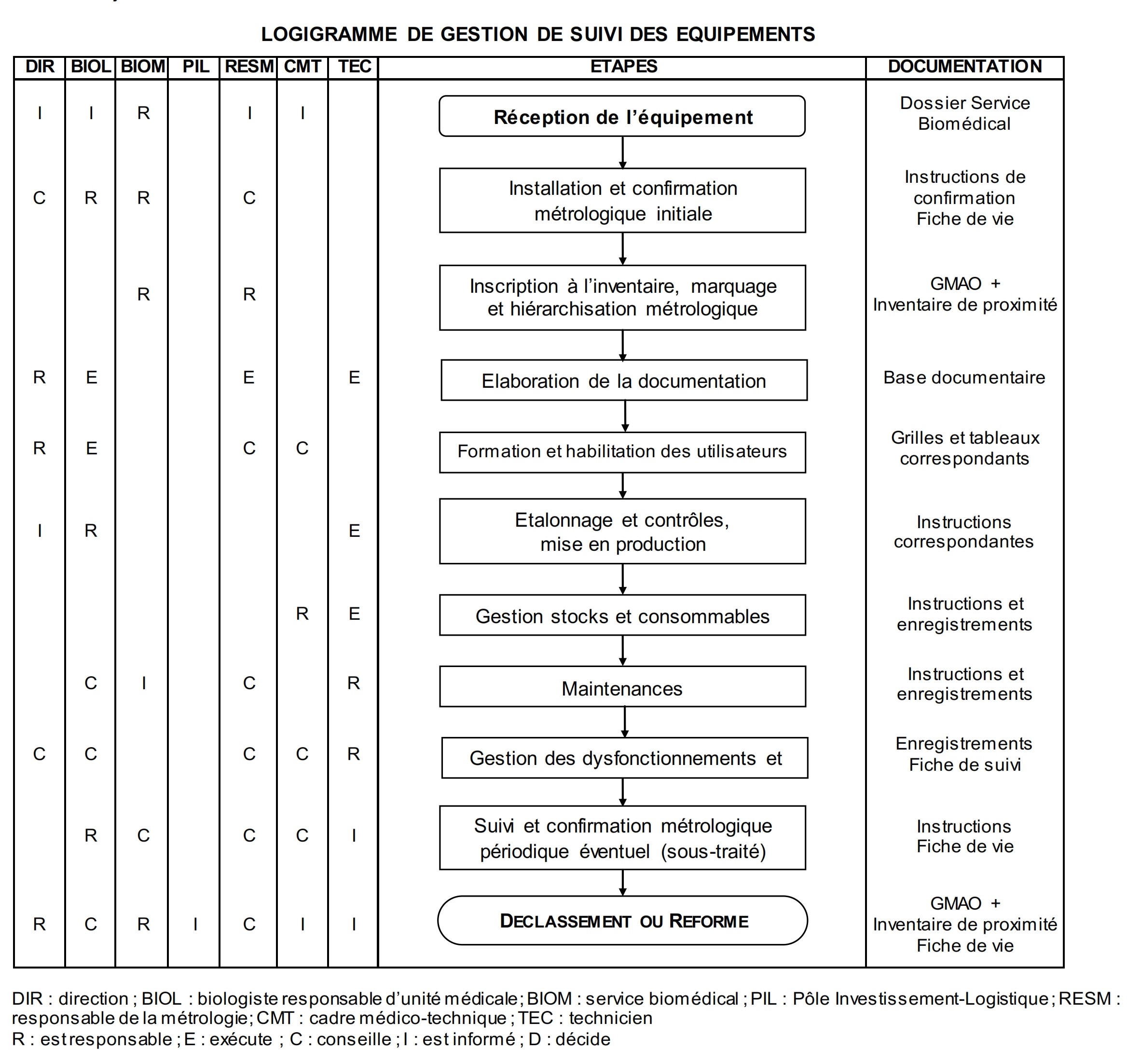
Annexe 2 : Processus
de confirmation métrologique
Annexe 3 : Certificat
d’accréditation.
Annexe 4 : Flux de la
maintenance préventive
Annexe 5 : Flux des
interventions
Annexe 6 : Flux des
rapports d’intervention
Annexe 7 : Exemple de
contrôle qualité
retour sommaire